Chemická rovnováha je stav reverzibilnej chemickej reakcie.
aA+ b B= c C+ d D,
pri ktorom nedochádza k zmene koncentrácií reaktantov v reakčnej zmesi v priebehu času. Charakterizuje sa stav chemickej rovnováhy chemická rovnovážna konštanta:
Kde C i- koncentrácia zložiek v rovnováha perfektná zmes.
Rovnovážnu konštantu možno vyjadriť aj ako rovnovážne mólové zlomky X i komponenty:
Pre reakcie prebiehajúce v plynnej fáze je vhodné vyjadriť rovnovážnu konštantu pomocou rovnovážnych parciálnych tlakov P i komponenty:
Pre ideálne plyny P i = C i RT A P i = X i P, Kde P je teda celkový tlak KP, K C A K X súvisia nasledujúcim vzťahom:
K P = K C (RT) c+d–a–b = K X P c+d–a–b. (9.4)
Rovnovážna konštanta súvisí s r G o chemická reakcia:
![]() (9.5)
(9.5)
![]() (9.6)
(9.6)
Zmeniť r G alebo r F v chemickej reakcii pri daných (nie nevyhnutne rovnovážnych) parciálnych tlakoch P i alebo koncentrácie C i zložky možno vypočítať pomocou rovnice izotermy chemických reakcií (van't Hoffove izotermy):
 . (9.7)
. (9.7)
 . (9.8)
. (9.8)
Podľa Le Chatelierov princíp, ak na systém, ktorý je v rovnováhe, pôsobí vonkajší vplyv, potom sa rovnováha posunie tak, aby sa zmenšil vplyv vonkajšieho vplyvu. Zvýšenie tlaku teda posúva rovnováhu smerom k zníženiu počtu molekúl plynu. Pridanie akejkoľvek reakčnej zložky do rovnovážnej zmesi posunie rovnováhu smerom k zníženiu množstva tejto zložky. Zvýšenie (alebo zníženie) teploty posúva rovnováhu smerom k reakcii, ktorá nastáva pri absorpcii (uvoľňovaní) tepla.
Kvantitatívna závislosť rovnovážnej konštanty od teploty je opísaná rovnicou izobary chemickej reakcie (van't Hoffove izobary)
![]() (9.9)
(9.9)
A izochóry chemickej reakcie (van't Hoffove izochory)
![]() . (9.10)
. (9.10)
Integračná rovnica (9.9) za predpokladu, že rH reakcia nezávisí od teploty (čo platí v úzkych teplotných rozsahoch), dáva:
![]() (9.11)
(9.11)
![]() (9.12)
(9.12)
Kde C – integračná konštanta. Teda závislosť ln K P od 1 /T musí byť lineárny a sklon priamky je – rH/R.
Integrácia v rámci K 1 , K 2 a T 1, T 2 dáva:
 (9.13)
(9.13)
 (9.14)
(9.14)
Pomocou tejto rovnice, poznáme rovnovážne konštanty pri dvoch rôznych teplotách, môžeme vypočítať rH reakcie. Podľa toho vedieť rH reakcie a rovnovážnej konštanty pri jednej teplote, môžete vypočítať rovnovážnu konštantu pri inej teplote.
PRÍKLADY
CO(g) + 2H2 (g) = CH30H(g)
za 500 K. f G o pre CO(g) a CH30H(g) pri 500 K sú rovné –155,41 kJ. mol –1 a –134,20 kJ. mol –1 resp.
Riešenie. G o reakcie:
r G o= f G o(CH3OH) – f G o(CO) = –134,20 – (–155,41) = 21,21 kJ. mol –1.
![]() = 6.09 10 –3 .
= 6.09 10 –3 .
Príklad 9-2. Reakčná rovnovážna konštanta
rovná K P = 1,64 10 –4 pri 400 o C. Aký celkový tlak treba vyvinúť na ekvimolárnu zmes N 2 a H 2, aby sa 10 % N 2 zmenilo na NH 3? Plyny sa považujú za ideálne.
Riešenie. Nechajte reagovať mol N2. Potom
| N2 (g) | + | 3H 2 (g) | = | 2NH3 (g) | |
| Pôvodné množstvo | 1 | 1 | |||
| Rovnovážne množstvo | 1– | 1–3 | 2 (Celkovo: 2 – 2) | ||
| Rovnovážny molárny zlomok: |
teda K X =  A KP = KX. P –2
=
A KP = KX. P –2
=  .
.
Dosadením = 0,1 do výsledného vzorca máme
1.64 10 –4 = , kde P= 51,2 atm.
, kde P= 51,2 atm.
Príklad 9-3. Reakčná rovnovážna konštanta
CO(g) + 2H2 (g) = CH30H(g)
pri 500 K sa rovná K P = 6,0910-3. Reakčná zmes pozostávajúca z 1 mol CO, 2 mol H2 a 1 mol inertného plynu (N2) sa zahreje na 500 K a celkový tlak 100 atm. Vypočítajte zloženie rovnovážnej zmesi.
Riešenie. Nechajte reagovať mol CO2. Potom
| CO(g) | + | 2 h 2 (g) | = | CH30H(g) | |
| Pôvodné množstvo: | 1 | 2 | 0 | ||
| Rovnovážne množstvo: | 1– | 2–2 | |||
| Celkom v rovnovážnej zmesi: | 3–2 molové zložky + 1 mol N 2 = 4–2 mol | ||||
| Rovnovážny molárny zlomok | |||||
teda K X =  A KP = KX. P–2 =
A KP = KX. P–2 = ![]() .
.
Teda 6,09 10 –3 = ![]() .
.
Vyriešením tejto rovnice dostaneme = 0,732. V súlade s tým sa mólové podiely látok v rovnovážnej zmesi rovnajú: = 0,288, = 0,106, = 0,212 a = 0,394.
Príklad 9-4. Na reakciu
N2 (g) + 3H2 (g) = 2NH3 (g)
pri 298 K K P = 6,0105, a f H o(NH 3) = –46,1 kJ. mol –1. Odhadnite hodnotu rovnovážnej konštanty pri 500 K.
Riešenie. Štandardná molárna entalpia reakcie je
r H o= 2f H o(NH 3) = –92,2 kJ. mol –1.
Podľa rovnice (9.14) 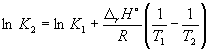 =
=
Ln (6,0105) + ![]() = –1,73, odkiaľ K 2 =
0.18.
= –1,73, odkiaľ K 2 =
0.18.
Všimnite si, že rovnovážna konštanta exotermickej reakcie klesá so zvyšujúcou sa teplotou, čo zodpovedá Le Chatelierovmu princípu.
ÚLOHY
- Pri 1273 K a celkovom tlaku 30 atm v rovnovážnej zmesi
- Pri 2000 o C a celkovom tlaku 1 atm sa 2 % vody disociuje na vodík a kyslík. Vypočítajte rovnovážnu konštantu reakcie
- Reakčná rovnovážna konštanta
- Reakčná rovnovážna konštanta
- 3-litrová nádoba obsahujúca 1,79 10 –2 mol I 2 bola zahriata na 973 K. Tlak v nádobe v rovnováhe bol 0,49 atm. Za predpokladu, že plyny sú ideálne, vypočítajte pre reakciu rovnovážnu konštantu pri 973 K
- Na reakciu
- Na reakciu
- 1-litrová nádoba obsahujúca 0,341 mol PCl 5 a 0,233 mol N 2 sa zahriala na 250 °C. Celkový tlak v nádobe pri rovnováhe bol 29,33 atm. Za predpokladu, že všetky plyny sú ideálne, vypočítajte rovnovážnu konštantu pri 250 o C pre reakciu prebiehajúcu v nádobe
- Reakčná rovnovážna konštanta
- Pri 25 o C f G o(NH 3) = –16,5 kJ. mol –1. Vypočítajte r G reakcie tvorby NH3 pri parciálnych tlakoch N2, H2 a NH3 rovných 3 atm, 1 atm a 4 atm, v tomto poradí. Akým smerom bude reakcia prebiehať spontánne za týchto podmienok?
- Exotermická reakcia
- Rovnovážna konštanta reakcie izomerizácie borneolu v plynnej fáze (C10H17OH) na izoborneol je 0,106 pri 503 K. Zmes 7,5 g borneolu a 14,0 g izoborneolu sa umiestnila do 5-litrovej nádoby a udržiavala sa pri 503 K, kým sa nedosiahne rovnováha. Vypočítajte mólové frakcie a hmotnosti borneolu a izoborneolu v rovnovážnej zmesi.
- Rovnováha v reakcii
- Vypočítajte celkový tlak, ktorý sa musí použiť na zmes 3 dielov H 2 a 1 dielu N 2, aby sa získala rovnovážna zmes obsahujúca 10 % objemových NH 3 pri 400 o C. Rovnovážna konštanta pre reakciu
- Pri 250 °C a celkovom tlaku 1 atm sa PCl 5 reakciou disociuje o 80 %.
- Pri 2000 °C na reakciu
- Vypočítajte štandardnú entalpiu reakcie, pre ktorú je rovnovážna konštanta
a) sa zvýši 2-krát, b) sa zníži 2-krát pri zmene teploty z 298 K na 308 K. - Závislosť rovnovážnej konštanty reakcie 2C 3 H 6 (g) = C 2 H 4 (g) + C 4 H 8 (g) od teploty medzi 300 K a 600 K je opísaná rovnicou
CO2(g) + C(tv) = 2CO(g)
obsahuje 17 % (objemových) C02. Koľko percent CO 2 bude obsiahnutých v plyne pri celkovom tlaku 20 atm? Pri akom tlaku bude plyn obsahovať 25 % CO 2 ?
H20 (g) = H2 (g) + 1/202 (g) za týchto podmienok.
CO(g) + H20 (g) = C02 (g) + H2 (g)
pri 500 o C sa rovná K p= 5,5. Zmes pozostávajúca z 1 mol CO a 5 mol H20 sa zahriala na túto teplotu. Vypočítajte molárny zlomok H 2 O v rovnovážnej zmesi.
N204 (g) = 2N02 (g)
pri 25 o C sa rovná K p= 0,143. Vypočítajte tlak, ktorý vznikne v nádobe s objemom 1 liter, do ktorej bol pri tejto teplote umiestnený 1 g N 2 O 4 .
I2(g) = 2I (g).
pri 250 o C r G o = –2508 J mol –1. Pri akom celkovom tlaku bude stupeň premeny PCl 5 na PCl 3 a Cl 2 pri 250 o C 30 %?
2HI (g) = H2 (g) + I2 (g)
rovnovážna konštanta K P = 1,83 10 –2 pri 698,6 K. Koľko gramov HI vznikne, keď sa 10 g I 2 a 0,2 g H 2 zahreje na túto teplotu v trojlitrovej nádobe? Aké sú parciálne tlaky H 2, I 2 a HI?
PCl5 (g) = PCl3 (g) + Cl2 (g)
CO(g) + 2H2 (g) = CH30H(g)
pri 500 K sa rovná K P = 6,0910-3. Vypočítajte celkový tlak potrebný na výrobu metanolu s výťažkom 90 %, ak sa CO a H2 odoberú v pomere 1:2.
CO(g) + 2H2 (g) = CH30H(g)
je v rovnováhe pri 500 K a 10 baroch. Ak sú plyny ideálne, ako ovplyvnia výťažok metanolu nasledujúce faktory: a) zvýšenie T; b) propagácia P; c) pridanie inertného plynu pri V= konštanta; d) pridanie inertného plynu pri P= konštanta; e) pridanie H2 at P= konštanta?
2NOCI(g) = 2NO(g) + Cl2(g)
nastavená na 227 °C a celkový tlak 1,0 bar, keď parciálny tlak NOCl je 0,64 bar (na začiatku bol prítomný iba NOCl). Vypočítajte r G o na reakciu. Pri akom celkovom tlaku bude parciálny tlak Cl 2 rovný 0,10 baru?
N2 (g) + 3H2 (g) = 2NH3 (g)
pri 400 o C sa rovná K = 1.60 10 –4 .
PCI5 (g) = PCI3 (g) + Cl2 (g).
Aký bude stupeň disociácie PCl 5, ak sa do systému pridá N 2 tak, aby parciálny tlak dusíka bol 0,9 atm? Celkový tlak sa udržiava na 1 atm.
N2 (g) + O2 (g) = 2NO (g)
Kp = 2,510-3. Rovnovážna zmes N2, O2, NO a inertného plynu pri celkovom tlaku 1 bar obsahuje 80 % (objemových) N2 a 16 % O2. Koľko percent objemu je NIE? Aký je parciálny tlak inertného plynu?
ln K = –1.04 –1088 /T +1.51 10 5 /T 2 .
Rovnice izobár, izochór, Van't Hoffove reakcie a Planckova rovnica
Takmer vždy je potrebné prejsť od jednej reakčnej podmienky k inej. Na to potrebujete poznať závislosť rovnovážnych konštánt od teploty a tlaku. Znalosť rovnovážnych konštánt pri rôznych teplotách a tlakoch rozširuje možnosti chemického technológa pri predpovedaní výsledkov procesu.
Závislosť rovnovážnej konštanty od teploty sa získa diferenciáciou reakčnej izotermy vzhľadom na teplotu za podmienky, že tlaky v kp sú nezávislé od teploty
Dostaneme výraz

delením všetkých členov tejto rovnice T, vyjadríme člen prostredníctvom d∆G/dT. Dosadíme to do diferencovaného vyjadrenia izotermy

Výsledná rovnica sa nazýva izobara Van't Hoffovej reakcie. Úplne identický prístup sa používa na odvodenie izochóry reakcie, pri ktorej sa využíva zmena Helmholtzovej energie a zloženie systému je vyjadrené v koncentráciách. Izochórový výraz má tvar

kde ∆Н a ∆U sú termodynamické tepelné účinky.
Aby sa získala závislosť rovnovážnej konštanty od tlaku, používa sa trochu iný prístup. k P a k s nezávisia od tlaku. Zo vzťahu medzi rovnovážnymi konštantami vyjadrenými rôznymi spôsobmi (6) je zrejmé, že konštanta k n závisí od tlaku: k n = k P ∙ P -∆ n
Zoberme si logaritmus tohto výrazu a potom ho diferencujme vzhľadom na P:
Všimnite si, že d ln k р /d P = 0 podľa podmienky; d ln P/d P = 1/P odkiaľ dostaneme d ln na N /d P = - ∆n/P; Nájdeme Δn z Clapeyronovej-Mendelejevovej rovnice a zapíšeme ho pre dva stavy v tvare PΔV = ΔnRT. Vyjadrime odtiaľto ΔV a dosadíme ho do diferencovaného vyjadrenia rovnovážnej konštanty
k n získame Planckovu rovnicu, vyjadrujúcu závislosť rovnovážnej konštanty od tlaku
Izochórové rovnice, reakčné izobary a Planckova rovnica majú prediktívnu hodnotu a sú veľmi zaujímavé pre technológov. Tieto rovnice sú kvantitatívnou charakteristikou Le Chatelierovho princípu posunu rovnováhy. Tento princíp možno formulovať takto: „Ak je rovnovážny systém ovplyvňovaný zvonka, pričom sa mení niektorá z podmienok, ktoré určujú rovnovážnu polohu, potom v systéme zosilnie smer, výsledkom čoho bude oslabenie vonkajšieho vplyvu a rovnovážna poloha sa posunie v rovnakým smerom." Najčastejšie podmienky, ktoré určujú rovnovážnu polohu, sú teplota, tlak a koncentrácia.
Predikčný význam odvodených rovníc ako kvantitatívnu charakteristiku princípu posunu rovnováhy ilustrujme na príklade syntézy amoniaku: N 2 + 3H 2 ↔ 2NH 3 - ∆H

Napíšme rovnicu izobary
Predpokladajme, že tento systém je vyhrievaný ΔH<0. Правая часть уравнения изотермы уменьшится (∆Н/RT 2)<0, значит левая часть тоже уменьшится: (d ln к р /d P)<0 (она может уменьшиться за счет уменьшения к р).

Rovnovážna konštanta pre syntézu amoniaku má tvar She
sa môže znížiť v dôsledku zníženia tlaku reakčných produktov a zvýšenia tlaku východiskových látok. To znamená, že pri zahrievaní sa táto exotermická reakcia posúva smerom k endotermickému procesu rozkladu amoniaku. Tento výsledok bol získaný na základe analýzy Van't Hoffovej izobary. Je ľahké ukázať, že súhlasí s predpoveďou Le Chatelierovho princípu. Podobný výsledok možno získať aplikáciou Planckových rovníc na analýzu tejto reakcie, pričom sa berie do úvahy, že tlak P je inverzný k 1/V objemu. Žiaci sú požiadaní, aby tieto činnosti vykonávali samostatne.
Závislosť reakčnej rovnovážnej konštanty od teploty možno opísať rovnicou izobary chemickej reakcie (van't Hoff izobara):
a izochory chemickej reakcie (van't Hoffove izochory):
![]()
Tu Δ H a A U- tepelný účinok reakcie prebiehajúcej pri konštantnom tlaku alebo konštantnom objeme. Ak Δ H> 0 (tepelný efekt je pozitívny, reakcia je endotermická), potom je teplotný koeficient konštantný
rovnováha je tiež pozitívna, to znamená, že so zvyšujúcou sa teplotou sa zvyšuje rovnovážna konštanta endotermickej reakcie, rovnováha sa posúva doprava (čo je celkom v súlade s Le Chatelierovým princípom).
Rovnovážna konštanta a konštanta reakčnej rýchlosti
Pre reverzibilnú chemickú reakciu môže byť rovnovážna konštanta vyjadrená pomocou rýchlostných konštánt priamych a spätných reakcií na základe skutočnosti, že v rovnováhe sú rýchlosti priamych a spätných reakcií rovnaké. Napríklad pre elementárnu reverzibilnú chemickú reakciu prvého rádu
je ľahké ukázať, že:
Kde k 1 je rýchlostná konštanta priamej reakcie a k 2 - spätný chod. Tento dôležitý vzťah poskytuje jeden z „kontaktných bodov“ medzi chemickou kinetikou a chemickou termodynamikou.
Metódy výpočtu rovnovážnej konštanty
Metódy výpočtu na určenie rovnovážnej konštanty reakcie zvyčajne spočívajú v tom, že jedným alebo druhým spôsobom sa vypočíta štandardná zmena Gibbsovej energie počas reakcie ( ΔG 0 ) a potom pomocou vzorca:
Malo by sa pamätať na to, že Gibbsova energia je funkciou stavu systému, to znamená, že nezávisí od dráhy procesu, od reakčného mechanizmu, ale je určená iba počiatočným a konečným stavom systému. . Ak teda priame určenie alebo výpočet ΔG 0 pre niektoré reakcie sú z nejakého dôvodu ťažké, môžete vybrať medzireakcie, pre ktoré ΔG 0 známe alebo sa dajú ľahko určiť a ich súčet poskytne príslušnú reakciu (pozri Hessov zákon). Ako také medzireakcie sa často používajú najmä reakcie tvorby zlúčenín z prvkov.
Entropický výpočet zmeny Gibbsovej energie a rovnovážnej konštanty reakcie
Metóda výpočtu entropie ΔG reakcia je jednou z najbežnejších a najpohodlnejších. Je založená na vzťahu:
alebo podľa toho pre štandardná Gibbsove energetické zmeny:
Tu ΔH 0 pri konštantnom tlaku a teplote sa rovná tepelnému účinku reakcie, ktorej metódy výpočtu a experimentálneho stanovenia sú známe - pozri napríklad Kirchhoffovu rovnicu:
![]()
Je potrebné získať zmenu entropie počas reakcie. Tento problém možno vyriešiť niekoľkými spôsobmi, napríklad:
Podľa tepelných údajov - na základe Nernstovej tepelnej vety a pomocou informácií o teplotnej závislosti tepelnej kapacity účastníkov reakcie. Napríklad pre látky, ktoré sú za normálnych podmienok v pevnom stave:
![]()
kde S 0 = 0 (Planckov postulát) a potom podľa toho,
![]() .
.
(tu je index sol z anglického solid). Pri určitej teplote T:
![]()
Pre látky, ktoré sú pri normálnej teplote kvapalné alebo plynné, alebo všeobecnejšie pre látky, ktoré prechádzajú fázovým prechodom v teplotnom rozsahu od 0 (alebo 298) do T, by sa mala brať do úvahy zmena entropie spojená s týmto fázovým prechodom. .
Pre ideálne plyny - metódami kvantovej štatistiky.
Pomocou rôznych empirických a semiempirických metód na to často stačí malé množstvo počiatočných údajov. Napríklad pre tuhé anorganické látky možno entropiu odhadnúť pomocou vzorca
kde A a B sú tabuľkové konštanty v závislosti od typu príslušnej zlúčeniny, M je molekulová hmotnosť.
Takže, ak sú známe a teplotné závislosti tepelnej kapacity, možno ju vypočítať pomocou vzorca:
Trochu zjednodušená verzia tohto vzorca sa získa tak, že sa súčet tepelných kapacít látok považuje za nezávislý od teploty a rovná sa súčtu tepelných kapacít pri 298 K:
A ešte zjednodušený výpočet sa vykoná prirovnaním súčtu tepelných kapacít k nule:
Prechod z do rovnovážnej konštanty sa uskutočňuje podľa vyššie uvedeného vzorca.
Le Chatelier-Brown princíp(1884) - ak je systém, ktorý je v stabilnej rovnováhe, ovplyvňovaný zvonku, pričom sa mení niektorá z podmienok rovnováhy (teplota, tlak, koncentrácia), potom sa v systéme zintenzívňujú procesy zamerané na kompenzáciu vonkajšieho vplyvu.
Henri Le Chatelier (Francúzsko) sformuloval tento termodynamický princíp mobilnej rovnováhy, neskôr zovšeobecnený Karlom Braunom
Zoberme si všeobecnú spätnú reakciu
Experimentálne štúdie ukazujú, že v rovnovážnom stave platí nasledujúci vzťah:

(hranaté zátvorky označujú koncentráciu). Uvedený vzťah je matematickým vyjadrením zákona o pôsobení hmoty, alebo zákona chemickej rovnováhy, podľa ktorého v stave chemickej rovnováhy pri určitej teplote je súčin koncentrácií produktov reakcie v mocninách, exponentoch
ktoré sa rovnajú zodpovedajúcim koeficientom v stechiometrickej reakčnej rovnici, delené podobným súčinom koncentrácií reaktantov v zodpovedajúcich mocninách, predstavuje konštantnú hodnotu. Táto konštanta sa nazýva rovnovážna konštanta. Vyjadrenie rovnovážnej konštanty z hľadiska koncentrácií produktov a činidiel je typické pre reakcie v roztokoch.
Všimnite si, že pravá strana výrazu pre rovnovážnu konštantu obsahuje iba koncentrácie rozpustených látok. Nemal by zahŕňať žiadne výrazy súvisiace s čistými pevnými látkami, čistými kvapalinami alebo rozpúšťadlami, ktoré sa zúčastňujú reakcie, pretože tieto výrazy sú konštantné.
Pri reakciách s plynmi je rovnovážna konštanta vyjadrená parciálnymi tlakmi plynov a nie ich koncentráciou. V tomto prípade je rovnovážna konštanta označená symbolom .
Koncentráciu plynu možno vyjadriť pomocou jeho tlaku pomocou stavovej rovnice ideálneho plynu (pozri časť 3.1):
Z tejto rovnice to vyplýva
kde je koncentrácia plynu, ktorú možno označiť ako [plyn]. Keďže - je konštantná hodnota, môžeme napísať, že pri danej teplote
Vyjadrime rovnovážnu konštantu pre reakciu medzi vodíkom a jódom pomocou parciálnych tlakov týchto plynov.
Rovnica pre túto reakciu má tvar
Preto je rovnovážna konštanta tejto reakcie daná pomocou
![]()
Všimnime si, že koncentrácie alebo parciálne tlaky produktov, t. j. látok uvedených na pravej strane chemickej rovnice, tvoria vždy čitateľa a koncentrácie alebo parciálne tlaky reaktantov, t. j. látok uvedených na ľavej strane chemickej rovnice rovnice, vždy tvoria menovateľ výrazu pre rovnovážnu konštantu.
Jednotky merania pre rovnovážnu konštantu
Rovnovážna konštanta môže byť rozmerová alebo bezrozmerná veličina v závislosti od typu jej matematického vyjadrenia. Vo vyššie uvedenom príklade je rovnovážna konštanta bezrozmerná veličina, pretože čitateľ a menovateľ zlomku majú rovnaké rozmery. V opačnom prípade má rovnovážna konštanta rozmer vyjadrený v jednotkách koncentrácie alebo tlaku.
Aký je rozmer rovnovážnej konštanty pre nasledujúcu reakciu?
Preto má rozmer (mol-dm-3)

Takže rozmer uvažovanej rovnovážnej konštanty je alebo dm3/mol.
Aký je rozmer rovnovážnej konštanty pre nasledujúcu reakciu?

Rovnovážna konštanta tejto reakcie je určená výrazom
Preto má rozmer
![]()

Takže rozmer tejto rovnovážnej konštanty je: atm alebo Pa.
Heterogénne rovnováhy
Doteraz sme uviedli iba príklady homogénnych rovnováh. Napríklad pri syntéze jodovodíka sú produkt aj obidve reaktanty v plynnom stave.
Ako príklad reakcie vedúcej k heterogénnej rovnováhe zvážte tepelnú disociáciu uhličitanu vápenatého
Rovnovážna konštanta tejto reakcie je daná vzťahom
![]()
Všimnite si, že tento výraz nezahŕňa žiadne výrazy súvisiace s dvomi tuhými látkami zapojenými do reakcie. V uvedenom príklade predstavuje rovnovážna konštanta disociačný tlak uhličitanu vápenatého. Ukazuje, že ak sa uhličitan vápenatý zahrieva v uzavretej nádobe, potom jeho disociačný tlak pri pevnej teplote nezávisí od množstva uhličitanu vápenatého. V ďalšej časti sa dozvieme, ako sa rovnovážna konštanta mení s teplotou. V uvažovanom príklade disociačný tlak presahuje 1 atm iba pri vyššej teplote, aby bol oxid
No, začíname sa dostávať k veci. Už by ste mali pochopiť, čo je to premenná a ako používať podmienky vo svojich programoch. Dúfam, že je to tak, inak všetko ostatné nemá zmysel čítať.
Keď som hovoril o premenných, vynechal som ešte jeden typ premennej. Táto premenná si na rozdiel od ostatných uchováva svoju hodnotu počas celého vykonávania programu. Spúšťa sa pri deklarácii a v ďalšom kóde sa nedá zmeniť. Táto premenná sa nazýva konštantný.
Načo sú konštanty? Na ukladanie trvalých informácií. Akokoľvek by som nerád uvádzal matematické porovnania, tie sú najzreteľnejšie. Pamätajte na fyziku - gravitačnú konštantu, teplotu v Kelvinoch, Fahrenheitoch atď. Toto všetko sú konštanty. V skutočnosti sme raz deklarovali takúto premennú a zabudli sme na jej význam a nahradili sme jej názov v programe. môžete sa opýtať, prečo nemôžete použiť jednoduchú premennú na uloženie takýchto informácií? Ale preto, že tejto premennej môžete priradiť inú hodnotu, ale nie konštante.
Pozrime sa na syntax a potom uvediem vizuálny príklad.
V C bola konštanta definovaná smernicou # definovať
#define PI 3.14 // PI bude teraz obsahovať 3.14
Túto smernicu možno nájsť v mnohých súčasných programoch, je to však zastaraný prístup. V C++ bol zavedený nový modifikátor konšt.
Konšt. float PI=3,14;\
Const float PI = 3,14; int _tmain(int argc, _TCHAR* argv) ( setlocale (0,""); //nastavenie predvoleného jazyka (ruština) int S,R=21; //plocha a polomer kruhu S=PI*R*R systém ("pauza" //zabránenie zatvorenia okna návrat 0;
Kdekoľvek túto premennú nazývame, všade sa bude rovnať 3,14. Veľmi pohodlné, nie? Mimochodom, kvôli experimentu skúste v programe priradiť PI nejakú hodnotu. Pozrite sa, ako kompilátor reaguje.
No, na záver, pokiaľ ide o konštanty, môžem povedať, že ako konštantu môžete použiť aritmetický výraz.
Const PROIZV=23*12; // teraz máme číslo 276 v konštante
Pamätajte tiež na jedno pravidlo - Konštantné mená by sa mali vždy písať veľkými písmenami! Aj to vám uľahčí život, pretože keď narazíte na správne naformátovanú konštantu, okamžite pochopíte, že ide o konštantu.
Spolu s konštantami sú široko používané v programovaní prevody. Vo svojom jadre je to súbor konštánt. Sú potrebné na obmedzenie rozsahu hodnôt premennej. Môže to byť deň v týždni, mesiac, pohlavie (manžel alebo manželka) atď. Enumerácie sú obzvlášť široko používané pri písaní hier.
No, zabudnime teraz na to, čo som napísal vyššie a pozrime sa na výčet ako príklad.
Enumerácie musia byť deklarované mimo hlavnej funkcie. Ide o to, že ide o programátorsky definovaný typ. A takéto typy spolu so štruktúrami a triedami by mali byť deklarované, najlepšie v samostatnom module. Ale na to všetko sa pozrieme oveľa neskôr. Tu je návod, ako sa deklaruje enumerácia:
enum mesiac (január, február, marth, apríl, máj, jún, júl, august, september, október, november, december);
Enumerácia začína kľúčovým slovom enum, potom názvom enumerácie ( toto nie je premenná!!!) a množina hodnôt je uvedená v zátvorkách.
Teraz môžeme použiť deklarovaný typ v našom programe:
Int main () ( Mesiac curMonth=Jún; // teraz //Júl je uložený v premennej curMonth)
Čo si myslíte, že je uložené v premennej curMonth? Ak si myslíte, že je jún, mýlite sa. Enumerácia je číselný typ a je implicitne pretypovaný na int. Číslovanie začína od 0. Keď to vieme, môžeme predpokladať, že curMonth obsahuje číslo 5. Inými slovami, mohli by sme tejto premennej priradiť namiesto názvu mesiaca jej číselnú obdobu pri interpretácii enumerácie a mali by sme pravdu.
Samozrejme, príklad s mesiacom alebo dňom v týždni nie je príliš jasný. Musíte však pochopiť, že premenná môže byť obmedzená na rozsah hodnôt. Skúste to, priraďte curMonth inú hodnotu ako enum a uvidíte, ako vás volá kompilátor J.
Ale v programovaní, napríklad pod Windowsom, sa často stretneme s enumeráciami a konštantami. Tu plne pochopíte pohodlie ich používania.
Teraz sa vráťme k nášmu príkladu a uvidíme, čo ešte môžeme zmeniť. Mesiace číslujeme od jednotky, nie od nuly. Z nášho kódu môžete vidieť, že jún 100 má priradenú hodnotu 5, nie 6. No v enumerácii si môžete nastaviť vlastné číslovanie.
Janovi som explicitne priradil hodnotu 1. Kompilátor sám priradí potrebné hodnoty zvyšným mesiacom. Samozrejme, všetko môžete robiť manuálne, ale nemá zmysel to robiť.
A nakoniec. Premennú je možné deklarovať aj pri zadávaní enumerácie:
Výpočtový mesiac (január=1, február, marth, apríl, máj, jún, júl, august, september, október, november, december) tento mesiac;
Potom sa táto premenná už môže použiť v programe. Môžete ich tam oznámiť veľa. Osobne sa mi však táto metóda nepáči, pretože je trochu mätúca. Veď neprogramujeme v C, ale v C++.
Obsadenie
Pozorne čítajte tu. Faktom je, že C++ je známy svojimi aritmetickými chybami vo výpočtoch. Nie, všetko vypočíta správne, ale výsledok výpočtu značne závisí od typu premennej. Programátor, ktorý sa rozhodne priradiť deliaci kvocient k typu int, často nemusí dostať požadovaný výsledok. Faktom je, že kompilátor jazyka vykonáva implicitné konverzie typov.
Tu je príklad. Musíme vypočítať mzdu zamestnanca. Poznáme hodinovú sadzbu. Potom túto hodnotu vynásobíme počtom odpracovaných hodín a dostaneme požadovaný výsledok. Všetko je tu jednoduché. Predstavte si však riaditeľa, ktorý najme zamestnanca a nevie, koľko mu má zaplatiť. Potom zoberie mzdu za kraj a vydelí ju počtom hodín.
Int zarp, hodina, vel; vel=22320; // plat v meste je 22 320 rubľov hodina=22 * 8; //počet hodín je 22 pracovných dní * 8 hodinový pracovný deň zarp=vel / hodina; // naša hodina cout<<"Час работника стоит =" < Program nám dá číslo 126 rubľov. To nám vyhovuje, ale je ľahké vziať si kalkulačku a vypočítať, že v skutočnosti je číslo 126,8 a ak zamestnanca tento nedostatok neurazí, potom sú takéto chyby vo výpočtoch neprijateľné. Čo sa stalo? zarp je celé číslo a ukladá iba celočíselnú hodnotu. Zlomková časť sa zahodí. Inými slovami, bolo potrebné použiť dvojitý typ, ktorý by uložil zlomok. Tu je však situácia o niečo zaujímavejšia. Kompilátor dočasne priradí premenným hodina a vel dvojitý typ, akoby rozšíril ich význam. Možno si to neuvedomujeme, aj keď je dôležité to pochopiť. Kompilátor, ktorý narazí na väčší typ, priradí svoj operand menšiemu typu. To je celé pravidlo. Predstavte si však situáciu, že paranoidný programátor márne plytvá pamäťou (pamätáte si, že typ double je 2x väčší ako int?) a všade sa snaží priradiť presne tento typ. Áno, dostane presnú hodnotu, obetuje určitý výkon (operácie s zlomkovými typmi sú pomalšie ako s celočíselnými typmi, ale to už nie je relevantné), ale umelo sa zatierate do kúta. Vráťme sa k nášmu riaditeľovi, ktorý stále nevie, koľko by mal za svoju prácu zaplatiť. Povedzme, že svedomitý účtovník mu dal hodinovú hodnotu 132,12 rubľov. Okamžite mu priradíte hodnotu double, začnete počítať a zavýjate, keď sa všade objavia centy. No, nemusíme ich dať zamestnancovi! V tomto prípade, ak ste urobili takúto chybu, môžete urobiť explicitné obsadenie. V C sa to robilo takto: (typ odliatku)výraz
(int)vel; // umelo previedol typ na celé číslo. V C++ predstavil Stroupstrup novú transformáciu. Tu je jeho popis: statické
_
obsadenie
<тип>(výraz)
Transformácie sa považujú za znak zlého programátorského vkusu. Ak máte príliš veľa konverzií, pravdepodobne budete musieť zmeniť všetky hodnoty v programe. V OOP sa však často používajú transformácie. Zatiaľ sa nimi nebudeme zaoberať, praxou všetko hneď pochopíte. Tak si choď oddýchnuť. Ďalšia lekcia bude ťažšia a oveľa dôležitejšia. Ponáhľam sa vás potešiť - z tohto základu zostáva niekoľko lekcií a začneme normálne programovanie.