РАДИОАКТИВНОСТЬ , свойство некоторых химических элементов к самопроизвольному распаду на другие элементы. Этот распад сопровождается различными корпускулярными и световыми радиациями. Явление радиоактивности было открыто в 1896 г. Г. Беккерелем. Он обнаружил, что соли U выделяют излучения, действующие на фотографическую пластинку и сообщающие воздуху электропроводность. Дальнейшие исследования показали, что испускание «лучей Беккереля» есть атомное свойство U, не зависящее от того, в каком химическом соединении он находится. Систематические исследования всех известных элементов обнаружили, что кроме U значительной радиоактивностью обладает только Th (Г. Шмит и М. Кюри, 1898 г.). Впоследствии была открыта еще слабая радиоактивность К и Rb. При изучении природных соединений U оказалось, что радиоактивность их значительно больше, чем следует ожидать по содержанию в них U. Высказанная М. Кюри гипотеза, что эта аномалия связана с присутствием в урановых минералах неизвестных сильно радиоактивных элементов, подтвердилась. Путем длительной и кропотливой работы П. и М. Кюри удалось выделить из урановой смоляной руды Иоахимстальского месторождения (Чехо-Словакия) новые элементы Ро (1898 г.) и Ra (1898 г.), радиоактивность которых в большое число раз превосходит радиоактивность U. Этим было положено начало открытию ряда новых радиоактивных элементов или радиоэлементов, число которых доходит до 40.
 Радиоактивные излучения
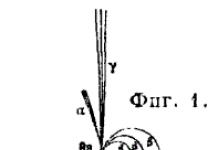
. По своей природе излучения радиоактивных элементов не однородны. В 1902 г. Е. Резерфорд предложил названия α-(альфа), β-(бета) и γ-(гамма) лучей для трех видов радиоактивных излучений, обладающих следующими свойствами: α-лучи образуются положительно заряженными быстро движущимися материальными частичками атомных размеров и слабо отклоняются в электрическом и магнитном поле в сторону, соответствующую отклонению каналовых лучей; они очень сильно поглощаются материей; β-лучи - частички отрицательного электричества (электроны); они значительно сильнее отклоняются магнитным полем и вполне аналогичны катодным лучам. Проницаемость их значительно больше, чем у α-лучей; γ-лучи не испытывают отклонения в магнитном поле и не несут заряда; они обладают самой большой проницаемостью (фиг. 1). α-частицы несут двойной элементарный положительный заряд, равный 9,55·10 -10 CGSE. Пo своей природе они тождественны с ядром атома гелия; α-частички вылетают из атома с определенной начальной скоростью, характерной для каждого α-излучающего радиоэлемента; эта начальная скорость лежит в пределах 1,4·10 9 -2,06·10 9 см/сек. В воздухе α-частицы благодаря своей большой массе движутся почти прямолинейно, растрачивая постепенно свою кинетическую энергию при столкновениях с молекулами газа и вызывая сильную ионизацию. α-частицы обладают определенной дальностью полета, пройдя которую они теряют свой заряд и способность вызывать характерные действия. Величина этой дальности полета или «пробега» α-частиц зависит от начальной скорости частицы и от поглощающего вещества. Величина пробега α-частицы характерна для каждого радиоэлемента и обнимает периоды 2,67-8,62 см в воздухе при 0°С и 760 мм. В твердых телах α-частицы задерживаются толщиной слоя порядка 0,1 мм. Свойство водяного пара конденсироваться при определенных условиях на ионах позволяет наблюдать и фотографировать пути α-частиц (фиг. 2).
Радиоактивные излучения
. По своей природе излучения радиоактивных элементов не однородны. В 1902 г. Е. Резерфорд предложил названия α-(альфа), β-(бета) и γ-(гамма) лучей для трех видов радиоактивных излучений, обладающих следующими свойствами: α-лучи образуются положительно заряженными быстро движущимися материальными частичками атомных размеров и слабо отклоняются в электрическом и магнитном поле в сторону, соответствующую отклонению каналовых лучей; они очень сильно поглощаются материей; β-лучи - частички отрицательного электричества (электроны); они значительно сильнее отклоняются магнитным полем и вполне аналогичны катодным лучам. Проницаемость их значительно больше, чем у α-лучей; γ-лучи не испытывают отклонения в магнитном поле и не несут заряда; они обладают самой большой проницаемостью (фиг. 1). α-частицы несут двойной элементарный положительный заряд, равный 9,55·10 -10 CGSE. Пo своей природе они тождественны с ядром атома гелия; α-частички вылетают из атома с определенной начальной скоростью, характерной для каждого α-излучающего радиоэлемента; эта начальная скорость лежит в пределах 1,4·10 9 -2,06·10 9 см/сек. В воздухе α-частицы благодаря своей большой массе движутся почти прямолинейно, растрачивая постепенно свою кинетическую энергию при столкновениях с молекулами газа и вызывая сильную ионизацию. α-частицы обладают определенной дальностью полета, пройдя которую они теряют свой заряд и способность вызывать характерные действия. Величина этой дальности полета или «пробега» α-частиц зависит от начальной скорости частицы и от поглощающего вещества. Величина пробега α-частицы характерна для каждого радиоэлемента и обнимает периоды 2,67-8,62 см в воздухе при 0°С и 760 мм. В твердых телах α-частицы задерживаются толщиной слоя порядка 0,1 мм. Свойство водяного пара конденсироваться при определенных условиях на ионах позволяет наблюдать и фотографировать пути α-частиц (фиг. 2).  β-лучи большинства радиоактивных веществ образуют несколько групп с различными начальными скоростями, распределение которых изучается по отклонению β-частиц в магнитном поле (спектр β-лучей). Начальные скорости β-частиц заключаются в пределах 8,7·10 9 -2,947·10 10 см/сек, т. е. до 0,988 скорости света. При прохождении через материю β-лучи рассеиваются значительно сильнее, чем α-лучи, мало изменяя свою скорость. Поглощение их происходит по закону, близкому к простому экспоненциальному I d = I 0 e - kd , где I d - интенсивность излучения, прошедшего толщину d, I 0 - начальная интенсивность, k - коэффициент поглощения. Характерной величиной может служить толщина слоя какого-либо вещества, например, алюминия, поглощающего β-лучи наполовину. Для различных β-лучей величина этого слоя 0,001-0,05 см алюминия. Наиболее жесткие β-лучи RaC поглощаются полностью двумя мм свинца, γ-лучи по своей природе совершенно аналогичны рентгеновым лучам и характеризуются длиной волны 10 -9 -10 -11 см. Поглощение γ-лучей сопровождается рассеянием и появлением вторичных β- и γ-лучей. Приближенно поглощение выражается простым показательным законом I = I 0 e -μх, причем в первом приближении удовлетворяется соотношение μ/ϱ = Const, где ϱ - плотность поглощающего вещества. Величина μ для γ-лучей различных радиоэлементов колеблется от 1000 до 0,12, чему соответствует толщина слоя Рb, поглощающего лучи наполовину, 10 -4 -5,5 см.
β-лучи большинства радиоактивных веществ образуют несколько групп с различными начальными скоростями, распределение которых изучается по отклонению β-частиц в магнитном поле (спектр β-лучей). Начальные скорости β-частиц заключаются в пределах 8,7·10 9 -2,947·10 10 см/сек, т. е. до 0,988 скорости света. При прохождении через материю β-лучи рассеиваются значительно сильнее, чем α-лучи, мало изменяя свою скорость. Поглощение их происходит по закону, близкому к простому экспоненциальному I d = I 0 e - kd , где I d - интенсивность излучения, прошедшего толщину d, I 0 - начальная интенсивность, k - коэффициент поглощения. Характерной величиной может служить толщина слоя какого-либо вещества, например, алюминия, поглощающего β-лучи наполовину. Для различных β-лучей величина этого слоя 0,001-0,05 см алюминия. Наиболее жесткие β-лучи RaC поглощаются полностью двумя мм свинца, γ-лучи по своей природе совершенно аналогичны рентгеновым лучам и характеризуются длиной волны 10 -9 -10 -11 см. Поглощение γ-лучей сопровождается рассеянием и появлением вторичных β- и γ-лучей. Приближенно поглощение выражается простым показательным законом I = I 0 e -μх, причем в первом приближении удовлетворяется соотношение μ/ϱ = Const, где ϱ - плотность поглощающего вещества. Величина μ для γ-лучей различных радиоэлементов колеблется от 1000 до 0,12, чему соответствует толщина слоя Рb, поглощающего лучи наполовину, 10 -4 -5,5 см.
Теория радиоактивного распада . Для объяснения радиоактивных явлений Резерфорд и Содди предложили в 1902 г. теорию атомного распада, полностью подтвержденную дальнейшими экспериментами. Атомы радиоактивных элементов являются неустойчивыми образованиями и подвершены самопроизвольному распаду, подчиненному закону случайности. При этом освобождается внутриатомная энергия в виде излучений, атом же претерпевает превращение, переходя в другой химический элемент с совершенно иными свойствами, например, металл Ra превращается в RaEm - инертный газ. Основной закон радиоактивного распада формулируется следующим образом: количество вещества ΔN, распадающегося в элемент времени Δt, пропорционально наличному его количеству N и промежутку времени Δt, т. е. ΔN=-λNΔt, или N t =N 0 e -Δ t где N 0 - начальное количество, N t - количество для момента t. Коэффициент пропорциональности λ носит название радиоактивной постоянной, или константы распада радиоэлемента. Более наглядно каждый радиоэлемент характеризуется периодом полураспада, т. е. промежутком времени, в течение которого начальное количество его уменьшается наполовину, или же средней продолжительностью жизни τ. Период полураспада Т, средняя продолжительность жизни τ и радиоактивная постоянная λ связаны между собой следующим образом: Т= 0,6931τ = 0,6931 τ -1 . Для различных радиоэлементов λ = 1,3·10 -13 - 10 11 сек., соответственно Т=5,2·10 17 сек. (1,65·10 10 лет)-10 -11 сек. Между λ и величиной пробега α-лучей R существует найденное эмпирически Гейгером и Нуталлом соотношение Ig λ = А + В lg R, где А и В - константы. Графическое изображение закона Гейгера и Нуталла дает для трех радиоактивных семейств U - Ra, Th и Ас три параллельные прямые. Этим законом приходится пользоваться, между прочим, для определения радиоактивных констант быстро распадающихся веществ. Явления радиоактивного распада, сопровождаемого вылетом из ядра атома α- и β-частиц, дали первое доказательство сложного строения атомного ядра, заключающего в качестве структурных элементов электроны, протоны и ядра Не. Закономерности, наблюдаемые в распределении длин волн γ-лучей и скоростей β- и α-частиц, указывают на существование в ядре устойчивых состояний, соответствующих определенным уровням энергии. γ-излучения по-видимому связаны с внутриядерными переходами α-частиц с одного уровня энергии на другой, причем длина волны γ-луча определяется из квантовых соотношений. При радиоактивном превращении, сопровождаемом вылетом α-частицы из ядра, она должна пройти через уровень потенциальной энергии, значительно превышающий собственную энергию частички, которой она обладает в ядре. С точки зрения классической теории невозможно объяснить вылет α-частички из ядра через этот «потенциальный барьер». Теории радиоактивного распада, основанные на принципах волновой механики, описывают движение α-частиц при помощи волновой функции, причем α-излучение является результатом постепенного проникновения волновой функции через вышеупомянутый потенциальный барьер. При этом можно найти теоретическое выражение для связи скорости α-частиц с константой распада атома, удовлетворяющее опытным данным. Принимая, что α-частички в ядре атома обладают той же величиной энергии, с какой они покидают ядро при распаде, мы получаем исходную величину для оценки абсолютных значений уровней энергии в ядре атома. Эти величины порядка 10 6 V (в обозначениях атомной физики). β-излучения радиоактивных элементов образуют, с одной стороны, группы электронов определенных скоростей, по всей вероятности появляющихся в результате фотоэффекта, вызываемого γ-излучением ядра в электронных оболочках атома, с другой стороны, β-частички, вылетающие из ядра, обладают скоростями самых различных значений (непрерывный магнитный спектр γ-лучей). Часто за α-превращением в ряду распада следуют два β-превращения, что ложно истолковать нарушением устойчивости электронных уровней в ядре при уменьшении числа α-частиц. Энергетические взаимоотношения в ядре, связанные с β-излучением, представляются еще не вполне ясными.
При распаде радиоактивного атома получается б. ч. также радиоактивный элемент. Т.о. образуются ряды распада , или радиоактивные семейства , последовательно превращающихся радиоэлементов. Закон радиоактивного распада дает возможность рассчитать количество любого из членов ряда для каждого момента времени при заданных начальных условиях. На практике важнее всего следующие случаи. 1) Распад отдельного радиоэлемента, например RaEm; количество радиоэлемента в любой момент выразится так: N t =N 0 e -λ t начальное количество (при t=0). 2) Образование из радиоэлемента с весьма большой продолжительностью жизни (количество которого за рассматриваемый промежуток времени практически не изменяется, например, образование UX (период полураспада 24 дня) из U (период полураспада 10 9 лет). В этом случае количество атомов образующегося элемента N 2 для момента t выразится через число атомов материнского элемента N 1 и соответствующие константы распада так:
3) Случай радиоактивного равновесия, когда сохраняется постоянное отношение чисел атомов последовательных элементов в ряду распада. В этом случае соблюдаются равенства: N 1 λ=N 2 λ 2 =…=N k λ k если рассматриваемый ряд содержит к элементов (фиг. 3, А - нарастание и В - распадение ТhХ). Превращение радиоэлементов всегда сопровождается α- или β-излучением. Неизвестно ни одного случая, когда радиоактивное превращение сопровождалось бы только одним γ-излучением.

Изучение радиоактивных превращений привело к открытию большого числа новых элементов. При попытках разместить радиоэлементы в периодической системе возникли затруднения, т. к. число свободных мест оказалось недостаточным. Эти затруднения удалось преодолеть в результате изучения химических особенностей радиоэлементов. Болтвуд, открывший в 1906 г. новый радиоактивный элемент ионий, показал, что его химические свойства совершенно совпадают со свойствами элемента тория. Далее подобная химическая идентичность была обнаружена у ряда радиоэлементов (Ra и MsTh, Pb, RaB, ТhВ, АсВ и др.), и в 1910 г. Содди высказал мысль, что эти элементы обладают принципиально одинаковыми свойствами, и их разделение методами химии невозможно. Группа таких неразличимых химически элементов называется по предложению Фаянса плеядой , а сами элементы по предложению Содди изотопами , т.к. они занимают одно и то же место в периодической системе. Тогда же Содди предположил, что и нерадиоактивные элементы могут являться смесью принципиально неразделимых элементов разного атомного веса, чем и объясняются дробные значения атомных весов большинства элементов. Эта идея Содди нашла себе блестящее подтверждение в работах Астона, открывшего методом положительных лучей изотопы обычных элементов. Понятие изотопии позволило разместить все радиоэлементы в периодической системе. Они обнимают 10 плеяд, расположенных в двух последних рядах периодической системы (фиг. 4).

Характерными элементами, или доминантами , плеяды радиоактивных изотопов служат элементы с наибольшей продолжительностью жизни, или устойчивые элементы. При этом пять из них: Ra, Em, Ро, Ас и Ра являются новыми элементами, занявшими свободные места в периодической системе, остальные же попадают на места, занятые ранее известными радиоэлементами U и Тh и неактивными Рb, Tl, Bi. Наибольшая разница в атомных весах радиоактивных изотопов не превосходит 8 единиц. Т. о. радиоактивные превращения позволили глубже вникнуть в физический смысл периодического закона и понятия о химическом элементе. Оказалось, что место элемента в периодической системе определяется не атомным весом элемента, как это принималось ранее, а величиной положительного заряда ядра его атома. Все свойства изотопов, связанные с электронными оболочками атома, в пределах точности наших экспериментов практически одинаковы (атомный объем, температура перехода из одного состояния в другое, термическое изменение размеров, магнитная восприимчивость, спектры и т. п.). Они отличаются кроме радиоактивных свойств только теми особенностями, которые связаны с массой ядра, например, в тонкой структуре спектра и в ничтожных различиях в константах диффузии. На последнем обстоятельстве основаны попытки разделения изотопов, приведшие в результате кропотливой работы к частичному успеху.
При радиоактивном распаде происходит превращение элементов, подчиняющееся следующим правилам сдвига (К. Фаянс). 1) После излучения α-частички элемент смещается на два места влево в периодической системе. 2) При β-превращении элемент смещается на одно место вправо (направление стрелок на фиг. 4). Эти правила указывают, что радиоактивность есть свойство ядра атома, ибо вылет α-частички, несущей два элементарных положительных заряда, уменьшает на две единицы заряд ядра, что соответствует уменьшению атомного номера на две единицы. β-частичка уносит один отрицательный заряд, т. е. увеличивает положительный заряд ядра, а, следовательно, и его атомный номер на единицу. В результате радиоактивных превращений два различных элемента могут занять одно и то же место в периодической системе.
Все известные нам радиоэлементы образуют три радиоактивных семейства, или ряда: семейство U-Ra, семейство Ас и семейство Th. Ряды U и Th самостоятельны, ряд же Ас по всем данным связан с рядом U-Ra. На фиг. 5 приведена схема радиоактивных семейств с их превращениями. Наибольший практический интерес представляют радиоэлементы Ra и MsTh, как обладающие весьма большой радиоактивностью и являющиеся источником сильно радиоактивных элементов малой продолжительности жизни (нaпpимер, RaEm, ThX и др.). Из других химических элементов только К и Rb обладают слабой радиоактивностью с испусканием β- и γ-лучей. Продукты их превращения неизвестны.

Действия радиоактивных излучений . 1) Все радиоактивные излучения производят ионизацию газов. При этом сильнее всего действуют α-лучи, действие β- и γ-лучей значительно слабее. В меньшей степени ионизация наблюдается у жидких и твердых диэлектриков. 2) Энергия радиоактивных излучений переходит при поглощении их материй в тепло. При этом наибольший эффект дают также α-лучи, обладающие максимальной энергией. Теоретически количество выделяемого тепла можно подсчитать, зная энергию излучений и кинетическую энергию остатка распавшегося атома. Экспериментально тепловое действие особенно тщательно изучено для Ra; 1 г Ra выделяет в час 25 cal, а вместе с продуктами распада 170 cal. 3) Сильные радиоактивные препараты светятся сами и вызывают свечение ряда тел. Вспышки на экране сернистого цинка, вызываемые отдельными α-частицами (сцинтилляции ), позволяют считать α-частицы, излучаемые радиоэлементами. 4) Многие вещества меняют свою окраску под действием радиоактивных излучений. 5) Радиоактивные лучи действуют на фотографическую пластинку. Прикладывая к фотографической пластинке плохо отшлифованную поверхность куска радиоактивной руды, можно получить радиографию распределения радиоактивных минералов по поверхности образца. 6) Под действием радиоактивных излучений происходят химические реакции, связанные главным образом с вызываемой ими ионизацией; некоторые действия β-лучей на коллоиды объясняются отрицательным зарядом самих β-частиц. 7) Действие радиоэлементов на живой организм сказывается в виде местных и общих явлений и сильно зависит от дозы. Действие радиоактивных излучений выражается в общем утомлении организма, изменении состава крови (уменьшение числа белых кровяных шариков и др.). При местном воздействии β-лучей больших количеств радиоэлементов может получиться ожог, трудно поддающийся излечению. Молодые клетки наиболее чувствительны к действию излучений. Введение внутрь организма больших количеств радиоэлементов влечет за собой смерть. Незначительные количества радиоэлементов оказывают благотворное действие на организм.
Практические приложения радиоактивности. 1) Свойство радиоэлементов ионизировать газы нашло свое применение в изготовлении радиоактивных коллекторов, служащих для измерения электрического поля, главным образом при исследованиях атмосферного электричества. Для этой цели употребляются обыкновенно α-излучатели Io или Во. Последний приходится периодически возобновлять, т. к. он распадается наполовину в 137 дней. 2) Радиоактивные Em м. б. использованы при определении газопроницаемости различных веществ. 3) При прохождении α-частиц через различные вещества наблюдается при определенных условиях появление Н-частичек (ядра водорода). Впервые явление это было обнаружено в 1919 г. Резерфордом в азоте и истолковано как результат разрушения ядра азота при столкновении с α-частичкой. Дальнейшие работы, главным образом сотрудников Резерфорда - Кирша и Петерсона, - показали, что большое число элементов разрушается под действием α-частиц. О других практических приложениях радиоактивности см. Радий .
Для количественного измерения радиоактивных веществ употребляется почти исключительно метод основанный на ионизации. В случае очень сильных препаратов возможно пользоваться для измерения ионизационных токов чувствительным гальванометром. Для измерения же малых количеств радиоэлементов пользуются электроскопами и электрометрами. Важнейшие схемы применяемых приборов представлены на фиг. 6.

1) Измерения по α-лучам . Исследуемое вещество радиоактивности помещается в тонко измельченном виде в плоской чашечке на дно «ионизационной камеры» электроскопа (фиг. 6а) или электрометра (фиг. 6б). Ионизационный ток измеряется по скорости спадания листка электроскопа, отсчитываемой по окулярной шкале микроскопа. При этом необходимо учитывать собственное спадание листка под влиянием дефектов изоляции и ионизации воздуха внутри прибора, определяемое специальным наблюдением в отсутствии радиоактивного вещества. При измерении с электрометром пользуются или методом зарядки или же компенсационными методами. При измерениях по α-лучам берут обычно слой вещества толщиной порядка 1 мм. Такой слой будет насыщенным для α-излучения, т. е. α-лучи из нижних частей уже поглощаются в самом активном веществе и не выходят наружу. При этом измеряемая ионизация приблизительно пропорциональна концентрации радиоэлементов в препарате. Обычно измерения производятся по сравнению с эталоном, содержащим известное количество определяемого радиоэлемента, например, U в равновесии с продуктами распада. Или же результаты выражают в урановых единицах , причем под урановой единицей подразумевается одностороннее излучение 1 см 2 насыщенного для α-лучей слоя окиси урана U 3 О 8 . В абсолютных единицах это соответствует току насыщения 1,73·10 -3 CGSE. В случае бесконечно тонкого слоя (например, активный налет, получаемый в присутствии эманаций на твердых телах и состоящий из продуктов их распада) ионизация пропорциональна количеству радио-элемента на препарате. 2) Измерения по γ-лучам . Благодаря большой проницаемости γ-лучей возможно с их помощью измерить количество радио-элементов (обычно Ra, RaEm или MsTh) в герметически запаянных препаратах. Измерения производятся по сравнению с эталоном, содержащим известное количество Ra. При измерении малых количеств Ra порядка 10 -5 -10 -7 г их помещают внутри прибора специального устройства. При измерении же больших количеств - от 10 -4 г и выше - испытуемый препарат помещается на некотором расстоянии снаружи прибора. 3) Измерения малых количеств RaEm производятся по α-лучам в электрометре с ионизационной камерой , приспособленной для введения Еm внутрь ее. Обычно приходится измерять Еm из водного раствора, при этом Em перегоняют в ионизационную камеру с током воздуха посредством циркуляции (фиг. 7) или каким-либо иным способом.

Далее измеряется ионизация, вызываемая α-лучами Em и продуктов ее воде источников. Этот же метод применяется при определении малых количеств Ra в растворе. Исследуемый раствор помещают в газопромывательную склянку L и освобождают от Em продуванием через него воздуха в течение 10-30 мин. Затем сосуд с раствором герметически закрывают и оставляют на несколько дней для накопления Em. Далее Em переводят в измерительный прибор J, где и определяют ее количество. Накопление эманации происходит по формуле Е=Е ∞ (1 е λ t), где Е - количество Em, накопленной в течение времени t, Е ∞ - количество ее, находящееся в равновесии с радием в данном растворе. Численно Е ∞ равно стольким кюри эманации, сколько грамм Ra находится в растворе.
Эталоном служит раствор с известным содержанием Ra порядка 10 -8 -10 -9 г. По Em возможно измерить 10 -10 г даже 10 -12 г Ra. 4) Измерение числа отдельных частиц производится или при помощи метода сцинтилляций или же путем соответствующего усиления ионизирующего действия отдельных частиц или импульсов (счетчик Гейгера ). Возможно также применение фотографической пластинки с толстым слоем (метод Л. В. Мысовского).
Радиоактивность была открыта в 1896 г. французским ученым Антуаном Анри Беккерелем при изучении люминесценции солей урана. Оказалось, что урановые соли без внешнего воздействия (самопроизвольно) испускали излучение неизвестной природы, которое засвечивало изолированные от света фотопластинки, ионизовало воздух, проникало сквозь тонкие металлические пластинки, вызывало люминесценцию ряда веществ. Таким же свойством обладали и вещества содержащие полоний 21084Ро и радий 226 88Ra.
Еще раньше, в 1985 г. были случайно открыты рентгеновские лучи немецким физиком Вильгельмом Рентгеном. Мария Кюри ввела в употребление слово «радиоактивность».
Радиоактивность – это самопроизвольное превращение (распад) ядра атома химического элемента, приводящее к изменению его атомного номера или изменению массового числа. При таком превращении ядра происходит испускание радиоактивных излучений.
Различаются естественная и искусственная радиоактивности. Естественной радиоактивностью называется радиоактивность, наблюдающаяся у существующих в природе неустойчивых изотопов. Искусственной радиоактивностью называется радиоактивность изотопов, полученных в результате ядерных реакций.
Существует несколько видов радиоактивного излучения, отличающихся по энергии и проникающей способности, которые оказывают неодинаковое воздействие на ткани живого организма.
Альфа-излучение - это поток положительно заряженных частиц, каждая из которых состоит из двух протонов и двух нейтронов. Проникающая способность этого вида излучения невелика. Оно задерживается несколькими сантиметрами воздуха, несколькими листами бумаги, обычной одеждой. Альфа-излучение может быть опасно для глаз. Оно практически не способно проникнуть через наружный слой кожи и не представляет опасности до тех пор, пока радионуклиды, испускающие альфа-частицы, не попадут внутрь организма через открытую рану, с пищей или вдыхаемым воздухом - тогда они могут стать чрезвычайно опасными. В результате облучения относительно тяжелыми положительно заряженными альфа-частицами через определенное время могут возникнуть серьезные повреждения клеток и тканей живых организмов.
Бета-излучение - это поток движущихся с огромной скоростью отрицательно заряженных электронов, размеры и масса которых значительно меньше, чем альфа-частиц. Это излучение обладает большей проникающей способностью по сравнению с альфа-излучением. От него можно защититься тонким листом металла типа алюминия или слоем дерева толщиной 1.25 см. Если на человеке нет плотной одежды, бета-частицы могут проникнуть через кожу на глубину несколько миллиметров. Если тело не прикрыто одеждой, бета-излучение может повредить кожу, оно проходит в ткани организма на глубину 1‑2 сантиметра.
Гамма-излучение, подобно рентгеновским лучам, представляет собой электромагнитное излучение сверхвысоких энергий. Это излучение очень малых длин волн и очень высоких частот. С рентгеновскими лучами знаком каждый, кто проходил медицинское обследование. Гамма-излучение обладает высокой проникающей способностью, защититься от него можно лишь толстым слоем свинца или бетона. Рентгеновские и гамма-лучи не несут электрического заряда. Они могут повредить любые органы.
Все виды радиоактивного излучения нельзя увидеть, почувствовать или услышать. Радиация не имеет ни цвета, ни вкуса, ни запаха. Скорость распада радионуклидов практически нельзя изменить известными химическими, физическими, биологическими и другими способами. Чем больше энергии передаст излучение тканям, тем больше повреждений вызовет оно в организме. Количество переданной организму энергии называется дозой. Дозу облучения организм может получить от любого вида излучения, в том числе и радиоактивного. При этом радионуклиды могут находиться вне организма или внутри его. Количество энергии излучения, которое поглощается единицей массы облучаемого тела, называется поглощенной дозой и измеряется в системе СИ в грэях (Гр).
При одинаковой поглощенной дозе альфа-излучение гораздо опаснее бета- и гамма-излучений. Степень воздействия различных видов излучения на человека оценивают с помощью такой характеристики как эквивалентная доза. разному повреждать ткани организма. В системе СИ ее измеряют в единицах, называемых зивертами (Зв).
Радиоактивным распадом называется естественное радиоактивное превращение ядер, происходящее самопроизвольно. Ядро, испытывающее радиоактивный распад, называется материнским; возникающее дочернее ядро, как правило, оказывается возбужденным, и его переход в основное состояние сопровождается испусканием γ-фотона. Т.о. гамма-излучение - основная форма уменьшения энергии возбужденных продуктов радиоактивных превращений.
Альфа-распад. β-лучи представляют собой поток ядер гелия Не. Альфа-распад сопровождается вылетом из ядра α-частицы (Не), при этом первоначально превращается в ядро атома нового химического элемента, заряд которого меньше на 2, а массовое число – на 4 единицы.
Скорости, с которыми α-частицы (т.е. ядра Не) вылетают из распавшегося ядра, очень велики (~106 м/с).
Пролетая через вещество, α-частица постепенно теряет свою энергию, затрачивая ее на ионизацию молекул вещества, и, в конце концов, останавливается. α-частица образует на своем пути примерно 106 пар ионов на 1 см пути.
Чем больше плотность вещества, тем меньше пробег α-частиц до остановки. В воздухе при нормальном давлении пробег составляет несколько см, в воде, в тканях человека (мышцы, кровь, лимфа) 0,1-0,15 мм. α-частицы полностью задерживаются обычным листком бумаги.
α- частицы не очень опасны в случае внешнего облучения, т.к. могут задерживаться одеждой, резиной. Но α-частицы очень опасны при попадании внутрь человеческого организма, из-за большой плотности производимой имим ионизации. Повреждения, возникающие в тканях не обратимы.
Бета-распад бывает трех разновидностей. Первый – ядро, претерпевшее превращение, испускает электрон, второе – позитрон, третье – называется электронный захват (е-захват), ядро поглощает один из электронов.
Третий вид распада (электронный захват) заключается в том, что ядро поглощает один из электронов своего атома, в результате чего один из протонов превращается в нейтрон, испуская при этом нейтрино:
Скорость движения β-частиц в вакууме равна 0,3 – 0,99 скорости света. Они быстрее чем α-частицы, пролетают через встречные атомы и взаимодействуют с ними. β–частицы обладают меньшим эффектом ионизации (50-100 пар ионов на 1 см пути в воздухе) и при попадании β-частицы внутрь организма они менее опасны чем α-частицы. Однако проникающая способность β-частиц велика (от 10 см до 25 м и до 17,5 мм в биологических тканях).
Гамма-излучение – электромагнитное излучение, испускаемое ядрами атомов при радиоактивных превращениях, которое распространяется в вакууме с постоянной скоростью 300 000 км/с. Это излучение сопровождает, как правило, β-распад и реже – α-распад.
γ-излучение подобно рентгеновскому, но обладает значительно большей энергией (при меньшей длине волны). γ–лучи, являясь электрически нейтральными, не отклоняются в магнитном и электрическом полях. В веществе и вакууме они распространяются прямолинейно и равномерно во все стороны от источника, не вызывая прямой ионизации, при движении в среде они выбивают электроны, передавая им часть или всю свою энергию, которые производят процесс ионизации. На 1см пробега γ-лучи образуют 1-2 пары ионов. В воздухе они проходят путь от нескольких сот метров и даже километров, в бетоне – 25 см, в свинце – до 5 см, в воде – десятки метров, а живые организмы пронизывают насквозь.
γ-лучи представляют значительную опасность для живых организмов как источник внешнего облучения.
Лекция
«Элементы ядерной физики»
Для лечебного факультета
Радиоактивность, её особенности, виды и характеристика. Естественные радиоактивные изотопы и их характеристика.
Явление радиоактивности было открыто в 1896 году Беккерелем (слайд 4,5).
Радиоактивность - это самопроизвольное превращение неустойчивых ядер одного элемента в ядра другого элемента. (слайд 6)
Это явление сопровождается убылью вещества и часто называется радиоактивным распадом.
Особенности:
a. Всегда происходит с выделением энергии.
b. Осуществляется по единому закону (закону радиоактивного распада).
c. Ограничен ≈ 10 видами распада (α-распад, β-распад, γ-распад, нейтронный, протонный и др. распады).
Оба вида радиоактивности не имеют физических различий и подчиняются одинаковым законам.
Естественные радиоактивные изотопы и их характеристика. (слайд 8)
Естественная радиоактивность осуществляется за счёт радиоактивных изотопов.
Естественные радиоактивные изотопы делят на первичные и вторичные.(слайд 9)
1. Первичные - образованы в земной коре при формировании Земли. Сейчас остались только первичные изотопы, имеющие период полураспада Т > 10 8 лет. К ним относятся члены радиоактивных семейств:
A. Семейство урана - радия.
Уран (238) - родоначальник семейства 238 92U в результате 14 радиоактивных превращений дает устойчивый изотоп свинца. 206 82Pb
Б. Семейство тория 232 90Th (Т = 1,39 · 10 10 лет) в результате 10 превращений даёт изотоп свинца. 208 32Pb
B. Семейство актиния 235 92U (Т = 7,3 · 10 8 лет) в результате 11 превращений даёт изотоп свинца. 207 32Pb
2. Вторичные - образуются под действием первичных изотопов или под действием космических лучей (протоны, α - частицы, ядра С, N, O 2 , фотоны. (Слайд 10, 11)
Особенности:
А. Подчиняются законам динамического равновесия: их образование уравновешивается распадом.
Б. Они включены в состав живых организмов. Большое биологическое значение имеет вторичный изотоп 14 С, который образуется из атмосферного азота под действием космических нейтронов. Изотоп углерода 14 С в виде СО 2 (углекислого газа) усваивается растениями => животными => человеком. При гибели живых растении и животных радиоактивность в них начинает убывать и по степени убыли можно определить возраст различных ископаемых.
"α", "β" и "γ" излучения и их характеристика.
Излучение радиоактивных веществ состоит из трёх компонентов:
1. α-лучи (α - частицы) - ионизированное излучение, несущее положительный заряд. | q | = | 2е | = 3,2 · 10 -19 Кл. Имеет структуру ядра гелия
4 2 He (слайд 20,21)
А = 4 - массовое число.
Z = 2 - порядковый номер (заряд ядра).
m α = 6,7 · 10 -27 кг.
Свойства:
A. Отклоняются электрическим и магнитным полями.
Б. ν α cp = 10 - 20000 км/с.
Е α = 1,8 ÷ 11,7 МэВ.
Спектр - линейчатый.
B. Пробег α - частицы зависит от вида среды
в воде - 0, 1 мм
в воздухе - 1 см.
Г. Обладают невысокими проникающими способностями (легко поглощаются тонкими слоями вещества; защитой от него являются лист картона, х/б ткань и т.п.).
Д. Имеют самую большую ионизационную способность из всех видов радиоактивных излучений (30 - 40 тысяч пар ионов на 1 см пути пробега в воздухе).
Е. При прохождении через слой вещества число α - частиц не изменяется, а постепенно изменяется их скорость. Когда толщина слоя достигает определенной величины, α-частицы поглощаются веществом все сразу.
2. β-лучи (β - частицы) - ионизированное излучение, состоящее из положительных и отрицательных β - частиц. (слайд 22,23)
β - или 0 -1е - электроны q е = 1,6 · 10 -19 Кл
β + или 0 +1е - позитроны m e = 9 · 10 -31 кг
Электроны и позитроны испускаются при ядерных превращениях или образуются при распаде нейтрона. Свойства:
А. Отклоняются электрическим и магнитным полем.
Б. ν β cp ≈ 150000 км/с.
Е β = 0,018 ÷ 4,8 МэВ.
Спектр - сплошной.
В. Пробег β - частиц в среде зависит от вида среды и энергии β - частиц
в воде - до 1, 5 см
в воздухе - до 100 см
Г. Обладают более высокой проникающей способностью, чем α - лучи (защитой от него является слой металла толщиной 3 мм).
Д. Ионизационная способность меньше, чем у α - лучей (300 - 400 пар ионов на 1 см пути пробега в воздухе).
E. Электронный β- распад наблюдается в основном у тех ядер, у которых число нейтронов (0 1n) больше числа протонов (1 1Pb)
Позитронный β - распад наблюдается, если число протонов больше числа нейтронов
Ж. β - частицы больших энергий, взаимодействуя с ядрами атомов, дают тормозное рентгеновское излучение.
3. γ-излучение - электромагнитное излучение, представляющее собой поток фотонов с высокой энергией (Е ф = 1 ÷ 3 МэВ). (слайд 24,25)
Это коротковолновое излучение (λ ≈ 0,1÷ 10 -5 нм) возникает как вторичное явление при α и β - распаде. Имеет природу, схожую с природой рентгеновского излучения.
Свойства:
A. Не отклоняется электрическим и магнитным полями.
Б. ν γ = ν света = 3 · 10 8 м/с.
Е γ = от 10 кэВ до 10 МэВ.
Спектр - линейчатый.
B. Обладает ионизационной способностью меньшей, чем у α и β - лучей (3-4 пары ионов на 1 см пути пробега в воздухе).
Г. Длина пробега γ- лучей в воздухе - до нескольких сот метров.
Д. Обладает очень высокой проникающей способностью (защитой является слой свинца, толщиной 20 см и больше).
В медицине широко используется для лечения глубоко расположенных злокачественных опухолей, в фармации - для стерилизации лекарств и лекарственных смесей.
2. Законы смещения при "α" и "β" распадах. (Слайд 26)
Законы смещения - это законы, по которым изменяются ядра радиоактивных элементов при "α" и "β" распаде.
При формулировке необходимо учитывать закон сохранения массы и закон сохранения заряда.
Закон сохранения массы:
Массовое число исходного продукта должно быть равно сумме массовых продуктов реакции.
Закон сохранения заряда:
Заряд ядра исходного продукта должен быть равен сумме зарядов ядер продуктов реакции.
1. Закон "α" - распада. (слайд 27)
При α - распаде образуется новое ядро с массовым числом на 4 единицы и порядковым номером на 2 единицы меньше, чем у исходного.
A ZX→ 4 2 He + A-4Z-2Y
226 88Ra→ 4 2 He+ 222 86 Rn (при этом получается фотон с Е = 0,188 МэВ)
Особенность: в естественных условиях встречается у элементов с порядковым номером Z > 83.
2. Законы электронного "β" – распада - (β -). (слайд 28)
При электронном β - распаде образуется новое ядро с тем же массовым числом и порядковым номером на 1 больше, чем у исходного:
A ZX→ A Z+1Y+ 0 -1 e
4019K→ 4020Ca+ 0 -1 e - распад изотопа калия с превращением его в кальций
3. Закон позитронного "β" - распада (β +) (слайд 29)
При позитронном β - распаде образуется новое ядро с тем же массовым числом и порядковым номером на 1 меньше, чем у исходного.
A ZX → A Z-1Y+ 0 +1 e
3015P→ 3014Si+ 0 +1 e Распад изотопа фосфора
Следствия из 1, 2 и 3 законов: (слайд 30)
"α" и "β" - распаду в некоторых случаях сопутствует излучение "γ" - квантов. Это излучение наблюдается так же при изомерном переходе ядер (из возбужденного в невозбужденное состояние);
(X) * = X + n γ ® число γ – квантов
возбужд. невозбужд.
состояние состояние
4. Электронный захват. (слайд 31)
При захвате электрона исходным ядром образуется новое ядро с тем же массовым числом, и порядковым номером на 1 меньше, чем у исходного.
Ядро захватывает электрон с ближайшей к нему оболочки
Þ Z X + -1 e ® Z -1 Y
7 4Be+ 0 -1e→ 7 3Li
Содержание статьи
РАДИОАКТИВНОСТЬ – превращение атомных ядер в другие ядра, сопровождающееся испусканием различных частиц и электромагнитного излучения. Отсюда и название явления: на латыни radio – излучаю, activus – действенный. Это слово ввела Мария Кюри (см . РАДИЙ). При распаде нестабильного ядра – радионуклида из него вылетают с большой скоростью одна или несколько частиц высокой энергии. Поток этих частиц называют радиоактивным излучением или попросту радиацией.
Лучи Рентгена.
Открытие радиоактивности было непосредственно связано с открытием Рентгена . Более того, некоторое время думали, что это один и тот же вид излучения. Конец 19 в. вообще был богат на открытие различного рода не известных до того «излучений». В 1880-е английский физик Джозеф Джон Томсон приступил к изучению элементарных носителей отрицательного заряда, в 1891 ирландский физик Джордж Джонстон Стони (1826–1911) назвал эти частицы электронами. Наконец, в декабре Вильгельм Конрад Рентген сообщил об открытии нового вида лучей, которые он назвал Х-лучами. До сих пор в большинстве стран они так и называются, но в Германии и России принято предложение немецкого биолога Рудольфа Альберта фон Кёлликера (1817–1905) называть лучи рентгеновскими. Эти лучи возникают, когда быстро летящие в вакууме электроны (катодные лучи) сталкиваются с препятствием. Было известно, что при попадании катодных лучей на стекло, оно испускает видимый свет – зеленую люминесценцию . Рентген обнаружил, что одновременно от зеленого пятна на стекле исходят какие-то другие невидимые лучи. Это произошло случайно: то в темной комнате светился находящийся неподалеку экран, покрытый тетрацианоплатинатом бария Ba (раньше его называли платиносинеродистым барием). Это вещество дает яркую желто-зеленую люминесценцию под действием ультрафиолетовых, а также катодных лучей. Но катодные лучи на экран не попадали, и более того, когда прибор был закрыт черной бумагой, экран продолжал светиться. Вскоре Рентген обнаружил, что излучение проходит через многие непрозрачные вещества, вызывает почернение фотопластинки, завернутой в черную бумагу или даже помещенной в металлический футляр. Лучи проходили через очень толстую книгу, через еловую доску толщиной 3 см, через алюминиевую пластину толщиной 1,5 см... Рентген понял возможности своего открытия: «Если держать руку между разрядной трубкой и экраном, – писал он, – то видны темные тени костей на фоне более светлых очертаний руки». Это было первое в истории рентгеноскопическое исследование.
Открытие Рентгена мгновенно облетело весь мир и поразило не только специалистов. В канун 1896 в книжном магазине одного немецкого города была выставлена фотография кисти руки. На ней были видны кости живого человека, а на одном из пальцев – обручальное кольцо. Это была снятая в рентгеновских лучах фотография кисти жены Рентгена. Первое сообщение Рентгена О новом роде лучей было опубликовано в «Отчетах Вюрцбургского физико-медицинского общества» 28 декабря оно было немедленно переведено и опубликовано в разных странах, выходящий в Лондоне самый известный научный журнал «Nature» («Природа») опубликовал статью Рентгена 23 января 1896.
Новые лучи стали исследовать во всем мире, только за один год на эту тему было опубликовано свыше тысячи работ. Несложные по конструкции рентгеновские аппараты появились и в госпиталях: медицинское применение новых лучей было очевидным.
Сейчас рентгеновские лучи широко используются (и не только в медицинских целях) во всем мире.
Лучи Беккереля.
Открытие Рентгена вскоре привело к не менее выдающемуся открытию. Его сделал в 1896 французский физик Антуан Анри Беккерель . Он был 20 января 1896 на заседании Академии, на котором физик и философ Анри Пуанкаре рассказал об открытии Рентгена и продемонстрировал сделанные уже во Франции рентгеновские снимки руки человека. Пуанкаре не ограничился рассказом о новых лучах. Он высказал предположение, что эти лучи связаны с люминесценцией и, возможно, всегда возникают одновременно с этим видом свечения, так что, вероятно, можно обойтись и без катодных лучей. Свечение веществ под действием ультрафиолета – флуоресценция или фосфоресценция (в 19 в. не было строгого разграничения этих понятий) было знакомо Беккерелю: ею занимались и его отец Александр Эдмонд Беккерель (1820–1891), и дед Антуан Сезар Беккерель (1788–1878) – оба физики; физиком стал и сын Антуана Анри Беккереля – Жак, который «по наследству» принял кафедру физики при парижском Музее естественной истории, эту кафедру Беккерели возглавляли 110 лет, с 1838 по 1948.

Беккерель решил проверить, связаны ли лучи Рентгена с флуоресценцией. Яркой желто-зеленой флуоресценцией обладают некоторые соли урана, например, уранилнитрат UO 2 (NO 3) 2 . Такие вещества были в лаборатории Беккереля, где работал. С препаратами урана работал еще его отец, который показал, что после прекращения действия солнечного света их свечение исчезает очень быстро – менее чем за сотую долю секунды. Однако никто не проверял, сопровождается ли это свечение испусканием каких-то других лучей, способных проходить сквозь непрозрачные материалы, как это было у Рентгена. Именно это после доклада Пуанкаре решил проверить Беккерель. 24 февраля 1896 на еженедельном заседании Академии он рассказал, что беря фотопластинку, завернутую в два слоя плотной черной бумаги, кладя на нее кристаллы двойного сульфата калия-уранила K 2 UO 2 (SO 4)2·2H2O и выставляя все это на несколько часов на солнечный свет, то после проявления фотопластинки на ней можно видеть несколько размытый контур кристаллов. Если между пластинкой и кристаллами поместить монету или вырезанную из жести фигуру, то после проявления на пластинке появляется четкое изображение этих предметов.
Все это могло свидетельствовать о связи флуоресценции и рентгеновского излучения. Недавно открытые Х-лучи можно получать намного проще – без катодных лучей и необходимых для этого вакуумной трубки и высокого напряжения, но надо было проверить, не оказывается ли, что урановая соль, нагреваясь на солнце, выделяет какой-то газ, который проникает под черную бумагу и действует на фотоэмульсию Чтобы исключить эту возможность, Беккерель проложил между урановой солью и фотопластинкой лист стекла – она все равно засветилась. «Отсюда, – заключил свое краткое сообщение Беккерель, – можно сделать вывод о том, что светящаяся соль испускает лучи, которые проникают через не прозрачную для света черную бумагу и восстанавливают серебряные соли в фотопластинке». Как будто Пуанкаре оказался прав и Х-лучи Рентгена можно получить совсем другим способом.
Беккерель начал ставить множество опытов, чтобы лучше понять условия, при которых появляются лучи, засвечивающие фотопластинку, и исследовать свойства этих лучей. Он помещал между кристаллами и фотопластинкой разные вещества – бумагу, стекло, пластинки алюминия, меди, свинца разной толщины. Результаты получались те же, что и у Рентгена, что также могло служить доводом в пользу сходства обоих излучений. Помимо прямого солнечного света Беккерель освещал соль урана светом, отраженным зеркалом или преломленным призмой. Он получил, что результаты всех прежних опытов никак не были связаны с солнцем; имело значение лишь то, как долго урановая соль находилась вблизи фотопластинки. На следующий день Беккерель доложил об этом на заседании Академии, но вывод он, как потом выяснилось, сделал неверный: он решил, что соль урана, хотя бы раз «заряженная» на свету, способна потом сама длительное время испускать невидимые проникающие лучи.
Беккерель до конца года он опубликовал на эту тему девять статей, в одной из них он писал: «Разные соли урана были помещены в толстостенный свинцовый ящик... Защищенные от действия любых известных излучений, эти вещества продолжали испускать лучи, проходящие через стекло и черную бумагу..., через восемь месяцев».
Эти лучи исходили от любых соединений урана, даже от тех, которые не светятся на солнце. Еще более сильным (примерно в 3,5 раза) оказалось излучение металлического урана. Стало очевидным, что излучение хотя и похоже по некоторым проявлениям на рентгеновское, но обладает большей проникающей способностью и как-то связано с ураном, так что Беккерель стал называть его «урановыми лучами».
Беккерель обнаружил также, что «урановые лучи» ионизируют воздух, делая его проводником электричества. Практически одновременно, в ноябре 1896, английские физики Дж. Дж.Томсон и Эрнест Резерфорд (обнаружили ионизацию воздуха и под действием рентгеновских лучей. Для измерения интенсивности излучения Беккерель использовал электроскоп, в котором легчайшие золотые листочки, подвешенные за концы и заряженные электростатически, отталкиваются и их свободные концы расходятся. Если воздух проводит ток, заряд с листочков стекает и они опадают – тем быстрее, чем выше электропроводность воздуха и, следовательно, больше интенсивность излучения.

Оставался вопрос, каким образом вещество испускает непрерывное и не ослабевающее в течение многих месяцев излучение без подвода энергии от внешнего источника Сам Беккерель писал, что не в состоянии понять, откуда уран получает энергию, которую он непрерывно излучает. По этому поводу выдвигались самые разные гипотезы, иногда довольно фантастические. Например, английский химик и физик Уильям Рамзай писал:»… физики недоумевали, откуда мог бы взяться неисчерпаемый запас энергии в солях урана. Лорд Кельвин склонялся к предположению, что уран служит своего рода западней, которая улавливает ничем другим не обнаруживаемую лучистую энергию, доходящую до нас через пространство, и превращает ее в такую форму, в виде которой она делается способной производить химические действия».

Беккерель не мог ни принять эту гипотезу, ни придумать что-то более правдоподобное, ни отказаться от принципа сохранения энергии. Кончилось тем, что он вообще на некоторое время бросил работу с ураном и занялся расщеплением спектральных линий в магнитном поле. Этот эффект был обнаружен почти одновременно с открытием Беккереля молодым голландским физиком Питером Зееманом и объяснен другим голландцем – Хендриком Антоном Лоренцем .


На этом закончился первый этап исследования радиоактивности. Альберт Эйнштейн сравнил открытие радиоактивности с открытием огня, так как считал, что и огонь и радиоактивность – одинаково крупные вехи в истории цивилизации.
Виды радиоактивных излучений.
Когда в руках исследователей появились мощные источники радиации, в миллионы раз более сильные, чем уран (это были препараты радия, полония , актиния), можно было более подробно ознакомиться со свойствами радиоактивного излучения. В первых исследованиях на эту тему самое активное участие приняли Эрнест Резерфорд супруги Мария и Пьер Кюри, А.Беккерель, многие другие. Прежде всего, была изучена проникающая способность лучей, а также действие на излучение магнитного поля. Оказалось, что излучение неоднородно, а представляет собой смесь «лучей». Пьер Кюри обнаружил, что при действии магнитного поля на излучение радия одни лучи отклоняются, а другие нет. Было известно, что магнитное поле отклоняет только заряженные летящие частицы, причем положительные и отрицательные в разные стороны. По направлению отклонения убедились в том, что отклоняемые b -лучи заряжены отрицательно. Дальнейшие опыты показали, что между катодными и b -лучами нет принципиальной разницы, откуда следовало, что они представляют собой поток электронов.
Отклоняющиеся лучи обладали более сильной способностью проникать через различные материалы, тогда как неотклоняющиеся легко поглощались даже тонкой алюминиевой фольгой – так вело себя, например, излучение нового элемента полония – его излучение не проникало даже сквозь картонные стенки коробки, в которой хранился препарат.
При использовании более сильных магнитов оказалось, что a -лучи тоже отклоняются, только значительно слабее, чем b -лучи, причем в другую сторону. Отсюда следовало, что они заряжены положительно и имеют значительно бóльшую массу (как потом выяснили, масса a -частиц в 7740 раз больше массы электрона). Впервые это явление обнаружили в 1899 А.Беккерель и Ф.Гизель. В дальнейшем выяснилось, что a -частицы представляют собой ядра атомов гелия (нуклид 4 Не) с зарядом +2 и массой 4 у.е. (см . УГЛЕРОДНАЯ ЕДИНИЦА.). Когда же в 1900 французский физик Поль Вийар (1860–1934) исследовал более подробно отклонение a - и b -лучей, он обнаружил в излучении радия и третий вид лучей, не отклоняющихся в самых сильных магнитных полях, это открытие вскоре подтвердил и Беккерель. Этот вид излучения, по аналогии с альфа- и бета-лучами, был назван гамма-лучами, обозначение разных излучений первыми буквами греческого алфавита предложил Резерфорд. Гамма-лучи оказались сходными с лучами Рентгена, т.е. они представляют собой электромагнитное излучение, но с более короткими длинами волн и соответственно с большей энергией. Все эти виды радиации описала М.Кюри (см . РАДИЙ) в своей монографии «Радий и радиоактивность» (опубликована в Париже в 1904, русский перевод – 1905). Вместо магнитного поля для «расщепления» радиации можно использовать электрическое поле, только заряженные частицы в нем будут отклоняться не перпендикулярно силовым линиям, а вдоль них – по направлению к отклоняющим пластинам.
Долгое время было неясно, откуда берутся все эти лучи. В течение нескольких десятилетий трудами многих физиков была выяснена природа радиоактивного излучения и его свойства, были открыты новые типы радиоактивности.
Альфа-лучи испускают, главным образом, ядра самых тяжелых и потому менее стабильных атомов (в периодической таблице они расположены после свинца). Эти высокоэнергетичные частицы. Обычно наблюдается несколько групп a -частиц, каждая из которых имеет строго определенную энергию. Так, почти все a -частицы, вылетающие из ядер 226 Ra, обладают энергией в 4,78 МэВ (мегаэлектрон-вольт) и небольшая доля a -частиц энергией в 4,60 МэВ. Другой изотоп радия – 221 Ra испускает четыре группы a -частиц с энергиями 6,76, 6,67, 6,61 и 6,59 МэВ. Это свидетельствует о наличии в ядрах нескольких энергетических уровней, их разность соответствует энергии излучаемых ядром g -квантов. Известны и «чистые» альфа-излучатели (например, 222 Rn).
По формуле E = mu 2 /2 можно подсчитать скорость a -частиц с определенной энергией. Например, 1 моль a -частиц с Е = 4,78 МэВ имеет энергию (в единицах СИ) Е = 4,78·10 6 эВ ґ 96500 Дж/(эВ·моль) = 4,61·10 11 Дж/моль и массу m = 0,004 кг/моль, откуда u » 15200 км/с, что в десятки тысяч раз больше скорости пистолетной пули. Альфа-частицы обладают самым сильным ионизирующим действием: сталкиваясь с любыми другими атомами в газе, жидкости или твердом теле, они «обдирают» с них электроны, создавая заряженные частицы. При этом a -частицы очень быстро теряют энергию: они задерживаются даже листом бумаги. В воздухе a -излучение радия проходит всего 3,3 см, a -излучение тория – 2,6 см и т.д. В конечном счете потерявшая кинетическую энергию a -частица захватывает два электрона и превращается в атом гелия. Первый потенциал ионизации атома гелия (He – e ® He +) составляет 24,6 эВ, второй (He + – e ® He +2) – 54,4 эВ, это намного больше, чем у любых других атомов. При захвате электронов a -частицами выделяется огромная энергия (более 7600 кДж/моль), поэтому ни один атом, кроме атомов самого гелия, не в состоянии удержать свои электроны, если по соседству окажется a -частица.
Очень большая кинетическая энергия a -частиц позволяет «увидеть» их невооруженным глазом (или с помощью обычной лупы), впервые это продемонстрировал в 1903 английский физик и химик Уильям Крукс (1832 – 1919. Он приклеил на кончик иглы еле видимую глазом крупинку радиевой соли и укрепил иглу в широкой стеклянной трубке. На одном конце этой трубки, недалеко от кончика иглы, помещалась пластинка, покрытая слоем люминофора (им служил сульфид цинка), а на другом конце было увеличительное стекло. Если в темноте рассматривать люминофор, то видно: все поле зрения усеяно вспыхивающими и сейчас же гаснущими искрами. Каждая искра – это результат удара одной a -частицы. Крукс назвал этот прибор спинтарископом (от греч. spintharis – искра и skopeo – смотрю, наблюдаю). С помощью этого простого метода подсчета a -частиц был выполнен ряд исследований, например, этим способом можно было довольно точно определить постоянную Авогадро (см . АВОГАДРО ЗАКОН).
В ядре протоны и нейтроны удерживаются вместе ядерными силами, Поэтому было непонятно, каким образом альфа-частица, состоящая из двух протонов и двух нейтронов, может покинуть ядро. Ответ дал в 1928 американский физик (эмигрировавший в 1933 из СССР)Джордж (Георгий Антонович) Гамов). По законам квантовой механики a -частицы, как и любые частицы малой массы, обладают волновой природой и потому у них есть некоторая небольшая вероятность оказаться вне ядра, на небольшом (примерно 6· 10 –12 см) расстоянии от него. Как только это происходит, на частицу начинает действовать с кулоновское отталкивание от очень близко находящегося положительно заряженного ядра.

Альфа-распаду подвержены, основном, тяжелые ядра – их известно более 200, a -частицы испускаются большинством изотопов элементов, следующих за висмутом. Известны ти более легкие альфа-излучатели, в основном, это атомы редкоземельных элементов. Но почему из ядра вылетают именно альфа-частицы, а не отдельные протоны? Качественно это объясняется энергетическим выигрышем при a -распаде (a -частицы – ядра гелия устойчивы). Количественная же теория a -распада была создана лишь в 1980-х, в ее разработке принимали участие и отечественные физики,в их числе Лев Давидович Ландау , Аркадий Бейнусович Мигдал (1911–1991), заведующий кафедрой ядерной физики Воронежского университета Станислав Георгиевич Кадменский с сотрудниками.

Вылет из ядра a -частицы приводит к ядру другого химического элемента, который смещен в периодической таблице на две клетки влево. В качестве примера можно привести превращения семи изотопов полония (заряд ядра 84) в разные изотопы свинца (заряд ядра 82): 218 Po ® 214 Pb, 214 Po ® 210 Pb, 210 Po ® 206 Pb, 211 Po ® 207 Pb, 215 Po ® 211 Pb, 212 Po ® 208 Pb, 216 Po ® 212 Pb. Изотопы свинца 206 Pb 207 Pb и 208 Pb стабильны, остальные радиоактивны.
Бета-распад.
Бета-распад наблюдается как у тяжелых, так и у легких ядер, например, у трития . Эти легкие частицы (быстрые электроны) обладают более высокой проникающей способностью. Так, в воздухе b -частицы могут пролететь несколько десятков сантиметров, в жидких и твердых веществах – от долей миллиметра до примерно 1 см. В отличие от a -частиц, энергетический спектр b -лучей не дискретный. Энергия вылетающих из ядра электронов может меняться почти от нуля до некоторого максимального значения, характерного для данного радионуклида. Обычно средняя энергия b -частиц намного меньше, чем у a -частиц; например, энергия b -излучения 228 Ra составляет 0,04 МэВ. Но бывают и исключения; так b -излучение короткоживущего нуклида 11 Ве несет энергию 11,5 МэВ. Долго было неясно, каким образом из одинаковых атомов одного и того же элемента вылетают частицы с разной скоростью. Когда же стало известно понятно строение атома и атомного ядра, появилась новая загадка: откуда вообще берутся вылетающие из ядра b -частицы – ведь в ядре никаких электронов нет. После того как в 1932 английский физик Джеймс Чедвиком открыл нейтрон, отечественные физики Дмитрий Дмитриевич Иваненко (1904–1994) и Игорь Евгеньевич Тамм и независимо немецкий физик Вернер Гейзенберг предположили, что атомные ядра состоят из протонов и нейтронов. В таком случае b -частицы должны образоваться в результате внутриядерного процесса превращения нейтрона в протон и электрон: n ® p + e. Масса нейтрона немного превышает суммарную массу протона и электрона, избыток массы, в соответствии с формулой Эйнштейна E = mc 2 , дает кинетическую энергию вылетающего из ядра электрона, поэтому b -распад наблюдается, в основном, у ядер с избыточным числом нейтронов. Например, нуклид 226 Ra – a -излучатель, а все более тяжелые изотопы радия (227 Ra, 228 Ra, 229 Ra и 230 Ra) – b -излучатели.


Оставалось выяснить, почему b -частицы, в отличие от a -частиц, имеют сплошной спектр энергии, это означало, что одни из них обладают очень малой энергией, а другие – очень большой (и при этом движутся со скоростью, близкую к скорости света). Более того, суммарная энергия всех этих электронов (она была измерена с помощью калориметра) оказалась меньше, чем разность энергии исходного ядра и продукта его распада. Снова физики с толкнулись с «нарушением» закона сохранения энергии: часть энергии исходного ядра непонятно куда исчезала. Незыблемый физический закон «спас» в 1931 швейцарский физик Вольфганг Паули , который предположил, что при b -распаде из ядра вылетают две частицы: электрон и гипотетическая нейтральная частица – нейтрино с почти нулевой массой, которая и уносит избыток энергии. Непрерывный спектр b -излучения объясняется распределением энергии между электронами и этой частицей. Нейтрино (как потом оказалось, при b -распаде образуется так называемое электронное антинейтрино ) очень слабо взаимодействует с веществом (например, легко пронзает по диаметру земной шар и даже огромную звезду) и потому долго не обнаруживалось – экспериментально свободные нейтрино были зарегистрированы только в 1956 г. Таким образом, уточненная схема бета-распада такова: n ® p + . Количественную теорию b -распада на основе представлений Паули о нейтрино разработал в 1933 итальянский физик Энрико Ферми , он же предложил название нейтрино (по-итальянски «нейтрончик»).
Превращение нейтрона в протон при b -распаде практически не изменяет массу нуклида, но увеличивает заряд ядра на единицу. Следовательно, образуется новый элемент, смещенный в периодической таблице на одну клетку вправо, например: ® , ® , получается стабильный нуклид (именно на этом примере Альварес открыл этот тип радиоактивности).

При К-захвате в электронной оболочке атома на место исчезнувшего электрона «спускается» электрон с более высокого энергетического уровня, излишек энергии либо выделяется в виде рентгеновского излучения, либо расходуется на вылет из атома более слабо связанных одного или нескольких электронов – так называемых оже-электронов, по имени французского физика Пьера Оже (1899–1993), открывшего этот эффект в 1923 (для выбивания внутренних электронов он использовал ионизирующее излучение).
В 1940 Георгий Николаевич Флеров (1913–1990) и Константин Антонович Петржак (1907–1998) на примере урана открыли самопроизвольное (спонтанное) деление, при котором нестабильное ядро распадается на два более легких ядра, массы которых различаются не очень сильно, например: ). Этот процесс сопровождается выделением огромной (по сравнению с химическими реакциями) энергии, что привело к созданию ядерного оружия и строительству АЭС.

В 1934 дочь Марии Кюри Ирэн Жолио-Кюри и ее муж Фредерик Жолио-Кюри открыли позитронный распад. В этом процессе один из протонов ядра превращается в нейтрон и антиэлектрон (позитрон) – частицу с той же массой, но положительно заряженную; одновременно из ядра вылетает нейтрино: p ® n + e + + 238. Масса ядра при этом не изменяется, а смещение происходит, отличие от b – -распада, влево, b +-распад характерен для ядер с избытком протонов (так называемые нейтронодефицитные ядра). Так, тяжелые изотопы кислорода 19 О, 20 О и 21 О b – -активны, а его легкие изотопы 14 О и 15 О b +-активны, например: 14 O ® 14 N + e + + 238. Как античастицы, позитроны сразу же уничтожаются (аннигилируют) при встрече с электронами с образованием двух g -квантов. Позитронный распад часто конкурирует с К-захватом.
В 1982 была открыта протонная радиоактивность: испускание ядром протона (это возможно лишь для некоторых искусственно полученных ядер, обладающих избыточной энергией). В 1960 физико-химик Виталий Иосифович Гольданский (1923–2001) теоретически предсказал двухпротонную радиоактивность: выбрасывание ядром двух протонов со спаренными спинами. Впервые она наблюдалась в 1970. Очень редко наблюдается и двухнейтронная радиоактивность (обнаружена в 1979).
В 1984 была открыта кластерная радиоактивность (от англ. cluster – гроздь, рой). При этом, в отличие от спонтанного деления, ядро распадается на осколки с сильно отличающимися массами, например, из тяжелого ядра вылетают ядра с массами от 14 до 34. Кластерный распад также наблюдается очень редко, и это в течение длительного времени затрудняло его обнаружение.
Некоторые ядра способны распадаться по разным направлениям. Например, 221 Rn на 80% распадается с испусканием b -частиц и на 20% – a -частиц, многие изотопы редкоземельных элементов (137 Pr, 141 Nd, 141 Pm, 142 Sm и др.) распадаются либо путем электронного захвата, либо с испусканием позитрона. Различные виды радиоактивных излучений часто (но не всегда) сопровождаются g -излучением. Происходит это потому, что образующееся ядро может обладать избыточной энергией, от которой оно освобождается путем испускания гамма-квантов. Энергия g -излучения лежит в широких пределах, так, при распаде 226 Ra она равна 0,186 МэВ, а при распаде 11 Ве достигает 8 МэВ.


Илья Леенсон
Литература:
Старосельская-Никитина О.А. История радиоактивности и возникновения ядерной физики
. М., изд-во АН СССР, 1963
Кудрявцев Л.С. История физики
, тт. 2, 3. М., Просвещение, 1956, 1971
Содди Ф. История атомной энергии
. М., Атомиздат, 1979
Кадменский С.Г. Радиоактивность атомных ядер: история, результаты, новейшие достижения
. «Соросовский образовательный журнал», 1999, № 11
Радиоактивность - это способность атомов некоторых изотопов самопроизвольно распадаться, испуская излучение. Впервые такое излучение, испускаемое ураном, обнаружил Беккерель, поэтому вначале радиоактивные излучения называли лучами Беккереля. Основной вид радиоактивного распада - выбрасывание из ядра атома альфа-частицы - альфа-распад (см. Альфа-излучение) или бета-частицы - бета-распад (см. Бета-излучение).
При радиоактивном распаде исходный превращается в атом другого элемента. В результате выбрасывания из ядра атома альфа-частицы, представляющей собой совокупность двух протонов и двух нейтронов, массовое число образующегося атома (см.) уменьшается на четыре единицы, и он оказывается сдвинутым в таблице Д. И. Менделеева на две клетки влево, так как порядковый номер элемента в таблице равен числу протонов в ядре атома. При выбрасывании бета-частицы (электрон) происходит превращение в ядре одного нейтрона в протон, вследствие чего образующийся атом оказывается сдвинутым в таблице Д. И. Менделеева на одну клетку вправо. Масса его при этом почти не изменяется. Выбрасывание бета-частицы сопряжено обычно с (см.).
Распад любого радиоактивного изотопа происходит по следующему закону: число распадающихся в единицу времени атомов (n) пропорционально числу атомов (N), имеющихся в наличии в данный момент времени, т. е. n=λN; коэффициент λ, называется постоянной радиоактивного распада и связан с периодом полураспада изотопа (Т) соотношением λ= 0,693/T. Указанный закон распада приводит к тому, что за каждый отрезок времени, равный периоду полураспада Т, количество изотопа уменьшается вдвое. Если образующиеся в результате радиоактивного распада атомы оказываются тоже радиоактивными, то происходит их постепенное накопление, пока не установится радиоактивное равновесие между материнским и дочерним изотопами; при этом число атомов дочернего изотопа, образующихся в единицу времени, равно числу атомов, распадающихся за то же время.
Известно свыше 40 естественных радиоактивных изотопов. Большая часть их расположена в трех радиоактивных рядах (семействах): урана-радия, и актиния. Все указанные радиоактивные изотопы широко распространены в природе. Присутствие их в горных породах, водах, атмосфере, растительных и живых организмах обусловливает естественную или природную радиоактивность.
Кроме естественных радиоактивных изотопов, сейчас известно около тысячи искусственно радиоактивных. Получают их путем ядерных реакций, в основном в ядерных реакторах (см. ). Многие естественные и искусственно радиоактивные изотопы широко используются в медицине для лечения (см. Лучевая терапия) и особенно для диагностики заболеваний (см. ). См. также Излучения ионизирующие.
Радиоактивность (от лат. radius - луч и activus - действенный) - способность неустойчивых ядер атомов самопроизвольно превращаться в другие, более устойчивые или стабильные ядра. Такие превращения ядер называются радиоактивными, а сами ядра или соответствующие атомы - радиоактивными ядрами (атомами). При радиоактивных превращениях ядра испускают энергию либо в виде заряженных частиц, либо в виде гамма-квантов электромагнитного излучения или гамма-излучения.
Превращения, при которых ядро одного химического элемента превращается в ядро другого элемента с другим значением атомного номера, называют радиоактивным распадом. Радиоактивные изотопы (см.), образовавшиеся и существующие в природных условиях, называют естественно радиоактивными; такие же изотопы, полученные искусственным путем посредством ядерных реакций,- искусственно радиоактивными. Между естественно и искусственно радиоактивными изотопами нет принципиальной разницы, так как свойства ядер атомов и самих атомов определяются только составом и структурой ядра и не зависят от способа их образования.
Радиоактивность была открыта в 1896 г. Беккерелем (А. Н. Becquerel), который обнаружил излучение урана (см.), способное вызывать почернение фотоэмульсии и ионизировать воздух. Кюри-Склодовская (М. Curie-Sklodowska) первая измерила интенсивность излучения урана и одновременно с немецким ученым Шмидтом (G. С. Schmidt) обнаружила радиоактивность у тория (см.). Свойство изотопов самопроизвольно испускать невидимое излучение супруги Кюри назвали радиоактивностью. В июле 1898 г. они сообщили об открытии ими в урановой смоляной руде нового радиоактивного элемента полония (см.). В декабре 1898 г. совместно с Бемоном (G. Bemont) они открыли радий (см.).
После открытия радиоактивных элементов ряд авторов (Беккерель, супруги Кюри, Резерфорд и др.) установил, что эти элементы могут испускать три вида лучей, которые по-разному ведут себя в магнитном поле. По предложению Резерфорда (Е. Rutherford, 1902) эти лучи были названы альфа- (см. Альфа-излучение), бета- (см. Бета-излучение) и гамма-лучами (см. Гамма-излучение). Альфа-лучи состоят из положительно заряженных альфа-частиц (дважды ионизированных атомов гелия Не4); бета-лучи- из отрицательно заряженных частиц малой массы - электронов; гамма-лучи по природе аналогичны рентгеновым лучам и представляют собой кванты электромагнитного излучения.
В 1902 г. Резерфорд и Содди (F. Soddy) объяснили явление радиоактивности самопроизвольным превращением атомов одного элемента в атомы другого элемента, происходящим по законам случайности и сопровождающимся выделением энергии в виде альфа-, бета-и гамма-лучей.
В 1910 г. М. Кюри-Склодовская вместе с Дебьерном (A. Debierne) получила чистый металлический радий и исследовала его радиоактивные свойства, в частности измерила постоянную распада радия. Вскоре был открыт ряд других радиоактивных элементов. Дебьерн и Гизель (F. Giesel) открыли актиний. Ган (О. Halm) открыл радиоторий и мезоторий, Болтвуд (В. В. Boltwood) открыл ионий, Ган и Майтнер (L. Meitner) открыли протактиний. Все изотопы этих элементов радиоактивны. В 1903 г. Пьер Кюри и Лаборд (С. A. Laborde) показали, что препарат радия имеет всегда повышенную температуру и что 1 г радия с продуктами его распада за 1 час выделяет около 140 ккал. В этом же году Рамзай (W. Ramsay) и Содди установили, что в запаянной ампуле с радием содержится газообразный гелий. Работами Резерфорда, Дорна (F. Dorn), Дебьерна и Гизеля было показано, что среди продуктов распада урана и тория имеются быстрораспадающиеся радиоактивные газы, названные эманациями радия, тория и актиния (радон, торон, актинон). Таким образом, было доказано, что при распаде атомы радия превращаются в атомы гелия и радона. Законы радиоактивных превращений одних элементов в другие при альфа- и бета-распадах (законы смещения) были впервые сформулированы Содди, Фаянсом (К. Fajans) и Расселлом (W. J. Russell).
Эти законы заключаются в следующем. При альфа-распаде всегда из исходного элемента получается другой, который расположен в периодической системе Д. И. Менделеева на две клетки левее исходного элемента (порядковый или атомный номер на 2 меньше исходного); при бета-распаде всегда из исходного элемента получается другой элемент, который расположен в периодической системе на одну клетку правее исходного элемента (атомный номер на единицу больше, чем у исходного элемента).
Изучение превращений радиоактивных элементов привело к открытию изотопов, т. е. атомов, которые обладают одинаковыми химическими свойствами и атомными номерами, но отличаются друг от друга по массе и по физическим свойствам, в частности по радиоактивным свойствам (типу излучения, скорости распада). Из большого количества открытых радиоактивных веществ новыми элементами оказались только радий (Ra), радон (Rn), полоний (Ро) и протактиний (Ра), а остальные - изотопами ранее известных урана (U), тория (Th), свинца (Pb), таллия (Tl) и висмута (Bi).
После открытия Резерфордом ядерной структуры атомов и доказательства, что именно ядро определяет все свойства атома, в частности структуру его электронных оболочек и его химические свойства (см. Атом, Ядро атомное), стало ясно, что радиоактивные превращения связаны с превращением атомных ядер. Дальнейшее изучение строения атомных ядер позволило полностью расшифровать механизм радиоактивных превращений.
Первое искусственное превращение ядер - ядерная реакция (см.) - было осуществлено Резерфордом в 1919 г. путем бомбардировки ядер атомов азота альфа-частицами полония. При этом ядра азота испускали протоны (см.) и превращались в ядра кислорода О17. В 1934 г. Ф. Жолио-Кюри и И. Жолио-Кюри (F. Joliot-Curie, I. Joliot-Curie) впервые получили искусственным путем радиоактивный изотоп фосфора бомбардируя альфа-частицами атомы Al. Ядра P30 в отличие от ядер естественно радиоактивных изотопов, при распаде испускали не электроны, а позитроны (см. Космическое излучение) и превращались в стабильные ядра кремния Si30. Таким образом, в 1934 г. были одновременно открыты искусственная радиоактивность и новый вид радиоактивного распада - позитронный распад, или β + -распад.
Супруги Жолио-Кюри высказали мысль о том, что все быстрые частицы (протоны, дейтоны, нейтроны) вызывают ядерные реакции и могут быть использованы для получения естественно радиоактивных изотопов. Ферми (Е. Fermi) с сотр., бомбардируя нейтронами различные элементы, получил радиоактивные изотопы почти всех химических элементов. В настоящее время при помощи ускоренных заряженных частиц (см. Ускорители заряженных частиц) и нейтронов осуществлено большое разнообразие ядерных реакций, в результате которых стало возможным получать любые радиоактивные изотопы.
В 1937 г. Альварес (L. Alvarez) открыл новый вид радиоактивного превращения - электронный захват. При электронном захвате ядро атома захватывает электрон с оболочки атома и превращается в ядро другого элемента. В 1939 г. Ган и Штрассманн (F. Strassmann) открыли деление ядра урана на более легкие ядра (осколки деления) при бомбардировке его нейтронами. В том же году Флеров и Петржак показали, что процесс деления ядер урана осуществляется и без внешнего воздействия, самопроизвольно. Тем самым они открыли новый вид радиоактивного превращения - самопроизвольное деление тяжелых ядер.
В настоящее время известны следующие виды радиоактивных превращений, совершающихся без внешних воздействий, самопроизвольно, в силу только внутренних причин, обусловленных структурой атомных ядер.
1. Альфа-распад . Ядро с атомным номером Z и массовым числом А испускает альфа-частицу - ядро гелия Не4- и превращается в другое ядро с Z меньшим на 2 единицы и А меньшим на 4 единицы, чем у исходного ядра. В общем виде альфа-распад записывается следующим образом:
Где X - исходное ядро, Y-ядро продукта распада.
2. Бета-распад
бывает двух типов: электронный и позитронный, или β - - и β + -распад (см. Бета-излучение). При электронном распаде из ядра вылетают электрон и нейтрино и образуется новое ядро с тем же массовым числом А, но с атомным номером Z на единицу большим, нем у исходного ядра:
При позитронном распаде ядро испускает позитрон и нейтрино и образуется новое ядро с тем же массовым числом, но с Z на единицу меньшим, чем у исходного ядра:
При бета-распаде в среднем 2/3 энергии ядра уносится частицами нейтрино (нейтральными частицами очень малой массы, очень слабо взаимодействующими с веществом).
3. Электронный захват
(прежнее название К-захват). Ядро захватывает электрон с одной из оболочек атома, чаще всего с К-оболочки, испускает нейтрино и превращается в новое ядро с тем же массовым числом А, но с атомным номером Z меньше на 1, чем у исходного ядра.
Превращение ядер при электронном захвате и позитронном распаде одинаковое, поэтому эти два вида распада наблюдаются одновременно для одних и тех же ядер, т. е. являются конкурирующими. Так как после захвата электрона с внутренней оболочки атома на его место переходит электрон с одной из более удаленных от ядра орбит, то электронный захват сопровождается всегда испусканием рентгеновского характеристического излучения.
4. Изомерный переход . После испускания альфа- или бета-частицы некоторые типы ядер находятся в возбужденном состоянии (состоянии с избыточной энергией) и испускают энергию возбуждения в виде гамма-квантов (см.Гамма-излучение). В этом случае при радиоактивном распаде ядро, кроме альфа- или бета-частиц, испускает также гамма-кванты. Так, ядра изотопа Sr90 испускают только β-частицы, ядра Na24 испускают, кроме β-частиц, также гамма-кванты. Большинство ядер находится в возбужденном состоянии очень малые промежутки времени, не поддающиеся измерению (менее 10 -9 сек.). Однако лишь относительно небольшое число ядер может находиться в возбужденном состоянии сравнительно большие промежутки времени - до нескольких месяцев. Такие ядра называются изомерами, а соответствующие переходы их из возбужденного состояния в нормальное, сопровождающиеся испусканием только гамма-квантов,- изомерными. При изомерных переходах А и Z ядра не изменяются. Радиоактивные ядра, испускающие только альфа- или бета-частицы, называются чистыми альфа- или бета-излучателями. Ядра, у которых альфа- или бета-распад сопровождается испусканием гамма-квантов, называются гамма-излучателями. Чистыми гамма-излучателями являются только ядра, находящиеся длительное время в возбужденном состоянии, т. е. претерпевающие изомерные переходы.
5. Самопроизвольное деление ядер
. В результате деления из одного ядра образуется два более легких ядра - осколки деления. Так как одинаковые ядра могут делиться различным образом на два ядра, то в процессе деления образуется много различных пар более легких ядер с различными Z и А. При делении освобождаются нейтроны, в среднем 2-3 нейтрона на один акт деления ядра, и гамма-кванты. Все образующиеся при делении осколки являются неустойчивыми и претерпевают β - -распад. Вероятность деления является очень малой для урана, но возрастает с увеличением Z. Этим объясняется отсутствие на Земле более тяжелых, чем уран, ядер. В стабильных ядрах существует определенное соотношение между числом протонов и нейтронов, при котором ядро обладает наибольшей устойчивостью, т.е. наибольшей энергией связи частиц в ядре. Для легких и средних ядер наибольшей их устойчивости соответствует примерно равное содержание протонов и нейтронов. Для более тяжелых ядер наблюдается относительное увеличение числа нейтронов в устойчивых ядрах. При избытке в ядре протонов или нейтронов ядра со средним значением А являются неустойчивыми и претерпевают β - - или β + -распады, при которых происходит взаимное превращение нейтрона и протона. При избытке нейтронов (тяжелые изотопы) происходит превращение одного из нейтронов в протон с испусканием электрона и нейтрино:![]()
При избытке протонов (легкие изотопы) происходит превращение одного из протонов в нейтрон с испусканием либо позитрона и нейтрино (β + -распад), либо только нейтрино (электронный захват):
Все тяжелые ядра с атомным номером больше, чему Pb82, являются неустойчивыми вследствие значительного количества протонов, отталкивающих друг друга. Цепочки последовательных альфа- и бета-распадов в этих ядрах происходят до тех пор, пока не образуются устойчивые ядра изотопов свинца. С улучшением экспериментальной техники у все большего количества ядер, считавшихся ранее стабильными, обнаруживают очень медленный радиоактивный распад. В настоящее время известно 20 радиоактивных изотопов с Z меньше 82.
В результате любых радиоактивных превращений количество атомов данного изотопа непрерывно уменьшается. Закон убывания с течением времени количества активных атомов (закон радиоактивного распада) является общим для всех видов превращений и всех изотопов. Он носит статистический характер (применим только для большого количества радиоактивных атомов) и заключается в следующем. Количество активных атомов данного изотопа, распадающихся за единицу времени ΔN/Δt, пропорционально количеству активных атомов N, т. е. за единицу времени распадается всегда одна и та же доля к активных атомов данного изотопа независимо от их количества. Величина к называется постоянной радиоактивного распада и представляет собой долю активных атомов, распадающихся за единицу времени, или относительную скорость распада. к измеряется в единицах, обратных единицам измерения времени, т. е. в сек.-1 (1/сек.), сутки-1, год-1 и т. п., для каждого радиоактивного изотопа имеет свое определенное значение, которое изменяется в очень широких пределах для различных изотопов. Величина, характеризующая абсолютную скорость распада, называется активностью данного изотопа или препарата. Активность 1 г вещества называется удельной активностью вещества.
Из закона радиоактивного распада следует, что убывание количества активных атомов N сначала происходит быстро, а затем все медленнее. Время, в течение которого количество активных атомов или активность данного изотопа уменьшается в два раза, называется периодом полураспада (Т) данного изотопа. Закон убывания N от времени t является экспоненциальным и имеет следующее аналитическое выражение: N=N0e-λt, где N0 - число активных атомов в момент начала отсчета времени (г=0), N - количество активных атомов спустя время t, е - основание натуральных логарифмов (число, равное 2,718...). Между постоянной распада к и периодом полураспада λ существует следующее соотношение: λТ-0,693. Отсюда![]()
Периоды полураспада измеряются в сек., мин. и т. п. и для различных изотопов изменяются в очень широких пределах от малых долей секунды до 10+21 лет. Изотопы, обладающие большими λ и малыми Т, называются короткоживущими, изотопы с
малыми λ и большими Т называются долгоживущими. Если активное вещество состоит из нескольких радиоактивных изотопов с различными периодами полураспада, генетически не связанных между собой, то с течением времени активность вещества также будет непрерывно уменьшаться и изотопный состав препарата будет все время изменяться: будет уменьшаться доля короткоживущих изотопов и возрастать доля долгоживущих изотопов. Через достаточно большой промежуток времени практически в препарате останется только самый долгоживущий изотоп. По кривым распада радиоактивных веществ, состоящих из одного или смеси изотопов, можно определить периоды полураспада отдельных изотопов и их относительные активности для любого момента времени.
Законы изменения активности генетически связанных изотопов качественно другие; они зависят от соотношения периодов их полураспада. Для двух генетически связанных изотопов с периодом Т1 для исходного изотопа и Т2 - продукта распада эти законы имеют наиболее простую форму. При T1>T2 активность исходного изотопа Q1 все время убывает по экспоненциальному закону с периодом полураспада Т1. Благодаря распаду ядер исходного изотопа будут образовываться ядра конечного изотопа и его активность Q2 будет возрастать. Спустя определенное время скорость распада ядер второго изотопа (станет близкой к скорости образования ядер этого изотопа из исходного (скорость распада исходного изотопа Q1) и эти скорости будут находиться в определенном и постоянном соотношении все дальнейшее время - наступает радиоактивное равновесие.
Активность исходного изотопа непрерывно убывает с периодом Т1, поэтому после достижения радиоактивного равновесия активность конечного изотопа Q2 и суммарная активность двух изотопов Q1+Q2 будут также убывать с периодом полураспада исходного изотопа Т1. При Т1>Т2 Q2=Q1. Если из исходного долгоживущего изотопа образуется последовательно несколько короткоживущих изотопов, как это имеет место в радиоактивном ряду урана и радия, то после достижения равновесия активности каждого короткоживущего изотопа становятся практически равными активности исходного изотопа. При этом общая активность равна сумме активностей всех короткоживущих продуктов распада и убывает с периодом: полураспада исходного долгоживущего изотопа, как и активность всех изотопов, находящихся в равновесии.
Радиоактивное равновесие достигается практически за время, равное 5-10 периодам полураспада того изотопа из продуктов распада, который имеет наибольший период полураспада. Если T1 К числу естественно радиоактивных изотопов относится около 40 изотопов периодической системы элементов с Z больше 82, которые образуют три последовательных ряда радиоактивных превращений: ряд урана (рис. 1), ряд тория (рис. 2) и ряд актиния (рис. 3). Путем последовательных альфа- и бета-распадов из исходных изотопов ряда получаются конечные устойчивые изотопы свинца. Стрелками на рисунках указаны последовательные радиоактивные превращения с указанием типа распада и процента атомов, претерпевающих распад данного типа. Горизонтальными стрелками обозначены превращения, совершающиеся почти в 100% случаев, а наклонными - в незначительной части случаев. При обозначении изотопов указаны периоды их полураспада. В скобках даны прежние названия членов ряда, указывающие генетическую связь, без скобок - принятые в настоящее время обозначения изотопов, соответствующие их химической и физической природе. В рамки заключены долгоживущие изотопы, а в двойные рамки - конечные стабильные изотопы. Альфа-распад обычно сопровождается очень малоинтенсивным гамма-излучением, часть бета-излучателей испускает интенсивное гамма-излучение. Естественный фон обусловлен природной радиоактивностью-излучением и воздействием естественно радиоактивных изотопов, содержащихся на поверхности Земли, в биосфере и воздухе, и космическим излучением (см.). Кроме указанных изотопов, в различных веществах содержатся также изотоп К40 и около 20 других радиоактивных изотопов с очень большими периодами полураспада (от 109 до 1021 лет), вследствие чего их относительная активность очень мала по сравнению с активностью других изотопов. Радиоактивные изотопы, содержащиеся в оболочке Земли, играли и играют исключительную роль в развитии нашей планеты, в частности в развитии и сохранении жизни, так как они компенсировали потери тепла, происходящие на Земле, и обеспечивали практическое постоянство температуры на планете в течение многих миллионов лет. Радиоактивные изотопы, подобно всем другим изотопам, содержатся в природе в основном в рассеянном состоянии и присутствуют во всех веществах, растительных и животных организмах. Вследствие различия физико-химических свойств изотопов относительное содержание их в почвах и водах оказывается неодинаковым. Газообразные продукты распада урана, тория и актиния - торон, радон и актинон - из почвенных вод непрерывно поступают в воздух. Кроме этих газообразных продуктов, в воздухе содержатся также альфа- и бета-активные продукты распада радия, тория и актиния (в виде аэрозолей). Из почвы радиоактивные элементы, как и стабильные, вместе с почвенными водами поступают в растения, поэтому стебли и листья растений всегда содержат уран, радий, торий с продуктами их распада, калий и ряд других изотопов, хотя и в относительно малых концентрациях. В растениях и животных также присутствуют изотопы С14, Н3, Be7 и другие, которые образуются в воздухе под воздействием нейтронов космического излучения. Вследствие того что совершается непрерывный обмен между человеческим организмом и окружающей средой, все радиоактивные изотопы, содержащиеся в пищевых продуктах, воде и воздухе, содержатся и в организме. Изотопы находятся в организме в следующих дозах: в мягких тканях-31 мбэр/год, в костях-44мбэр/год. Доза от космического излучения составляет 80-90 мбэр/год, доза от внешнего гамма-излучения - 60-80 мбэр/год. Суммарная доза равна 140-200 мбэр/год. Доза, падающая на легкие, - 600-800 мбэр/год. Искусственно радиоактивные изотопы получаются путем бомбардировки стабильных изотопов нейтронами или заряженными частицами в результате различных ядерных реакций, в качестве источников заряженных частиц используются различные типы ускорителей. Об измерениях потоков и доз различных видов ионизирующих излучений - см. Дозиметрия, Дозы ионизирующих излучений, Нейтрон. Вследствие того что большие дозы радиации вредно отражаются на здоровье людей, при работе с источниками излучений и радиоактивными изотопами применяются специальные меры защиты (см. ). В медицине и биологии изотопы используют для изучения обмена веществ, в диагностических и терапевтических целях (см. ). Содержание радиоактивных изотопов в организме и динамику их обмена определяют при помощи счетчиков внешнего излучения от человека.
Рис. 1. Ряд урана.
Рис. 2. Ряд тория.
Рис. 3. Ряд актиния.