Kesetimbangan kimia adalah keadaan reaksi kimia yang dapat dibalik.
aA+ B B= C C+ D D,
dimana tidak ada perubahan konsentrasi reaktan dalam campuran reaksi seiring waktu. Keadaan kesetimbangan kimia dicirikan konstanta kesetimbangan kimia:
Di mana C saya– konsentrasi komponen dalam keseimbangan campuran sempurna.
Konstanta kesetimbangan juga dapat dinyatakan dalam fraksi mol kesetimbangan X saya komponen:
Untuk reaksi yang terjadi dalam fase gas, lebih mudah untuk menyatakan konstanta kesetimbangan dalam tekanan parsial kesetimbangan hal komponen:
Untuk gas ideal hal = C dan RT Dan hal = X aku P, Di mana P Oleh karena itu, adalah tekanan total K P, K C Dan K X dihubungkan oleh hubungan berikut:
K P = K C (RT) c+d–a–b = K X P c+d–a–b. (9.4)
Konstanta kesetimbangan berhubungan dengan r G o reaksi kimia:
![]() (9.5)
(9.5)
![]() (9.6)
(9.6)
Mengubah r G atau r F dalam reaksi kimia pada tekanan parsial tertentu (belum tentu kesetimbangan). hal atau konsentrasi C saya komponen dapat dihitung menggunakan persamaan isoterm reaksi kimia (isoterm van't Hoff):
 . (9.7)
. (9.7)
 . (9.8)
. (9.8)
Berdasarkan Prinsip Le Chatelier, jika suatu pengaruh luar diberikan pada suatu sistem yang berada dalam keadaan setimbang, maka kesetimbangan tersebut akan bergeser sehingga mengurangi pengaruh pengaruh luar tersebut. Jadi, peningkatan tekanan menggeser kesetimbangan ke arah penurunan jumlah molekul gas. Menambahkan komponen reaksi apa pun ke dalam campuran kesetimbangan akan menggeser kesetimbangan ke arah penurunan jumlah komponen tersebut. Kenaikan (atau penurunan) suhu menggeser kesetimbangan menuju reaksi yang terjadi dengan penyerapan (pelepasan) panas.
Ketergantungan kuantitatif konstanta kesetimbangan pada suhu dijelaskan oleh persamaan isobar reaksi kimia (isobar van't Hoff)
![]() (9.9)
(9.9)
Dan isokore reaksi kimia (isokore van't Hoff)
![]() . (9.10)
. (9.10)
Mengintegrasikan persamaan (9.9) dengan asumsi bahwa r H reaksi tidak bergantung pada suhu (yang berlaku pada rentang suhu yang sempit), menghasilkan:
![]() (9.11)
(9.11)
![]() (9.12)
(9.12)
Di mana C - konstanta integrasi. Jadi, ketergantungan ln K P dari 1 /T harus linier, dan kemiringan garis lurus tersebut adalah – r H/R.
Integrasi di dalam K 1 , K 2, dan T 1, T 2 memberi:
 (9.13)
(9.13)
 (9.14)
(9.14)
Dengan menggunakan persamaan ini, dengan mengetahui konstanta kesetimbangan pada dua suhu berbeda, kita dapat menghitungnya r H reaksi. Oleh karena itu, mengetahui r H reaksi dan konstanta kesetimbangan pada suatu suhu, Anda dapat menghitung konstanta kesetimbangan pada suhu lain.
CONTOH
CO(g) + 2H 2 (g) = CH 3 OH(g)
pada 500 K. f Pergi untuk CO(g) dan CH 3 OH(g) pada 500 K sama dengan –155,41 kJ. mol –1 dan –134,20 kJ. mol –1 masing-masing.
Larutan. Pergi reaksi:
r Pergilah= f Pergi(CH3OH) – f Pergi(CO) = –134,20 – (–155,41) = 21,21 kJ. mol –1 .
![]() = 6.09 10 –3 .
= 6.09 10 –3 .
Contoh 9-2. Konstanta kesetimbangan reaksi
sama dengan K P = 1,64 10 –4 pada 400 o C. Berapakah tekanan total yang harus diberikan pada campuran ekuimolar N 2 dan H 2 agar 10% N 2 berubah menjadi NH 3? Gas dianggap ideal.
Larutan. Biarkan satu mol N2 bereaksi. Kemudian
| N 2 (g) | + | 3H 2 (g) | = | 2NH 3 (g) | |
| Kuantitas asli | 1 | 1 | |||
| Kuantitas keseimbangan | 1– | 1–3 | 2 (Jumlah: 2–2) | ||
| Fraksi mol kesetimbangan: |
Karena itu, K X =  Dan K P = K X . P –2
=
Dan K P = K X . P –2
=  .
.
Mengganti = 0,1 ke dalam rumus yang dihasilkan, kita mendapatkan
1.64 10 –4 = , Di mana P= 51,2 atm.
, Di mana P= 51,2 atm.
Contoh 9-3. Konstanta kesetimbangan reaksi
CO(g) + 2H 2 (g) = CH 3 OH(g)
pada 500 K sama dengan K P = 6,09 10 –3 . Campuran reaksi yang terdiri dari 1 mol CO, 2 mol H 2 dan 1 mol gas inert (N 2) dipanaskan hingga 500 K dan tekanan total 100 atm. Hitung komposisi campuran kesetimbangan.
Larutan. Biarkan satu mol CO bereaksi. Kemudian
| Gigi) | + | 2H 2 (g) | = | CH3OH(g) | |
| Kuantitas asli: | 1 | 2 | 0 | ||
| Besaran kesetimbangan: | 1– | 2–2 | |||
| Total campuran dalam kesetimbangan: | 3–2 mol komponen + 1 mol N 2 = 4–2 mol | ||||
| Fraksi mol kesetimbangan | |||||
Karena itu, K X =  Dan K P = K X . P–2 =
Dan K P = K X . P–2 = ![]() .
.
Jadi, 6,09 10 –3 = ![]() .
.
Memecahkan persamaan ini, kita mendapatkan = 0,732. Jadi fraksi mol zat dalam campuran kesetimbangan adalah: = 0,288, = 0,106, = 0,212 dan = 0,394.
Contoh 9-4. Untuk reaksi
N 2 (g) + 3H 2 (g) = 2NH 3 (g)
pada 298 K K P = 6,0 10 5 , sebuah f H o(NH 3) = –46,1 kJ. mol –1 . Perkirakan nilai konstanta kesetimbangan pada 500 K.
Larutan. Entalpi molar standar reaksinya adalah
r H o= 2f H o(NH 3) = –92,2 kJ. mol –1 .
Menurut persamaan (9.14), 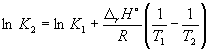 =
=
Ln (6.0 10 5) + ![]() = –1,73, dari mana K 2 =
0.18.
= –1,73, dari mana K 2 =
0.18.
Perhatikan bahwa konstanta kesetimbangan reaksi eksotermik menurun dengan meningkatnya suhu, yang sesuai dengan prinsip Le Chatelier.
TUGAS
- Pada 1273 K dan tekanan total 30 atm dalam campuran kesetimbangan
- Pada 2000 o C dan tekanan total 1 atm, 2% air terdisosiasi menjadi hidrogen dan oksigen. Hitung tetapan kesetimbangan reaksi tersebut
- Konstanta kesetimbangan reaksi
- Konstanta kesetimbangan reaksi
- Sebuah bejana 3 liter berisi 1,79 10 –2 mol I 2 dipanaskan hingga 973 K. Tekanan dalam bejana pada kesetimbangan ternyata 0,49 atm. Dengan asumsi gas ideal, hitunglah tetapan kesetimbangan pada 973 K untuk reaksi tersebut
- Untuk reaksi
- Untuk reaksi
- Sebuah bejana 1 liter berisi 0,341 mol PCl 5 dan 0,233 mol N 2 dipanaskan hingga 250 o C. Tekanan total dalam bejana pada kesetimbangan adalah 29,33 atm. Dengan asumsi semua gas ideal, hitunglah konstanta kesetimbangan pada 250 o C untuk reaksi yang terjadi di dalam bejana
- Konstanta kesetimbangan reaksi
- Pada suhu 25 o C f Pergi(NH 3) = –16,5 kJ. mol –1 . Menghitung r G reaksi pembentukan NH 3 pada tekanan parsial N 2, H 2 dan NH 3 berturut-turut sebesar 3 atm, 1 atm dan 4 atm. Ke arah manakah reaksi akan berlangsung secara spontan pada kondisi seperti ini?
- Reaksi eksotermik
- Tetapan kesetimbangan reaksi fasa gas isomerisasi borneol (C 10 H 17 OH) menjadi isoborneol adalah 0,106 pada 503 K. Campuran 7,5 g borneol dan 14,0 g isoborneol ditempatkan dalam bejana 5 liter dan disimpan pada 503 K sampai kesetimbangan tercapai. Hitung fraksi mol dan massa borneol dan isoborneol dalam campuran kesetimbangan.
- Kesetimbangan dalam reaksi
- Hitung tekanan total yang harus diberikan pada campuran 3 bagian H 2 dan 1 bagian N 2 untuk memperoleh campuran kesetimbangan yang mengandung 10% NH 3 volume pada 400 o C. Tetapan kesetimbangan reaksi
- Pada 250 o C dan tekanan total 1 atm, PCl 5 terdisosiasi sebesar 80% melalui reaksi
- Pada suhu 2000 o C untuk reaksi
- Hitung entalpi standar reaksi yang tetapan kesetimbangannya
a) bertambah 2 kali lipat, b) berkurang 2 kali lipat bila suhu berubah dari 298 K menjadi 308 K. - Ketergantungan konstanta kesetimbangan reaksi 2C 3 H 6 (g) = C 2 H 4 (g) + C 4 H 8 (g) pada suhu antara 300 K dan 600 K dijelaskan dengan persamaan
CO 2 (g) + C(tv) = 2CO(g)
mengandung 17% (berdasarkan volume) CO 2 . Berapa persentase CO2 yang terkandung dalam gas pada tekanan total 20 atm? Pada tekanan berapa gas tersebut akan mengandung 25% CO2?
H 2 O (g) = H 2 (g) + 1/2O 2 (g) pada kondisi berikut.
CO(g) + H 2 O(g) = CO 2 (g) + H 2 (g)
pada 500 o C adalah sama Kp= 5,5. Campuran yang terdiri dari 1 mol CO dan 5 mol H 2 O dipanaskan sampai suhu ini. Hitung fraksi mol H 2 O dalam campuran kesetimbangan.
N 2 O 4 (g) = 2NO 2 (g)
pada 25 o C adalah sama Kp= 0,143. Hitung tekanan yang akan terjadi dalam bejana dengan volume 1 liter, di mana 1 g N 2 O 4 ditempatkan pada suhu ini.
Saya 2 (g) = 2Saya (g).
pada suhu 250 oC r G o = –2508 J mol –1. Pada tekanan total berapa derajat konversi PCl 5 menjadi PCl 3 dan Cl 2 pada 250 o C menjadi 30%?
2HI(g) = H 2 (g) + Saya 2 (g)
konstanta kesetimbangan K P = 1,83 10 –2 pada 698,6 K. Berapa gram HI yang terbentuk jika 10 g I 2 dan 0,2 g H 2 dipanaskan sampai suhu tersebut dalam bejana berukuran tiga liter? Berapa tekanan parsial H 2, I 2 dan HI?
PCl 5 (g) = PCl 3 (g) + Cl 2 (g)
CO(g) + 2H 2 (g) = CH 3 OH(g)
pada 500 K sama dengan K P = 6,09 10 –3 . Hitung tekanan total yang diperlukan untuk menghasilkan metanol dengan rendemen 90% jika CO dan H2 diambil dengan perbandingan 1:2.
CO(g) + 2H 2 (g) = CH 3 OH(g)
berada dalam kesetimbangan pada 500 K dan 10 bar. Jika gasnya ideal, bagaimana faktor-faktor berikut akan mempengaruhi hasil metanol: a) meningkat T; b) promosi P; c) menambahkan gas inert pada V= konstanta; d) menambahkan gas inert pada P= konstanta; e) menambahkan H 2 pada P= konstanta?
2NOCl(g) = 2NO(g) + Cl 2 (g)
diatur pada 227 o C dan tekanan total 1,0 bar ketika tekanan parsial NOCl 0,64 bar (awalnya hanya ada NOCl). Menghitung r Pergilah untuk reaksi. Pada tekanan total berapa tekanan parsial Cl 2 sama dengan 0,10 bar?
N 2 (g) + 3H 2 (g) = 2NH 3 (g)
pada suhu 400 o C adalah sama K = 1.60 10 –4 .
PCl 5 (g) = PCl 3 (g) + Cl 2 (g).
Berapakah derajat disosiasi PCl 5 jika N 2 ditambahkan ke dalam sistem sehingga tekanan parsial nitrogen menjadi 0,9 atm? Tekanan total dipertahankan pada 1 atm.
N 2 (g) + O 2 (g) = 2NO (g)
K p = 2,5 10 –3 . Campuran kesetimbangan N 2, O 2, NO dan gas inert pada tekanan total 1 bar mengandung 80% (volume) N 2 dan 16% O 2. Berapa persentase volume NO? Berapa tekanan parsial gas inert?
dalam K = –1.04 –1088 /T +1.51 10 5 /T 2 .
Persamaan isobar, isokore, reaksi Van't Hoff dan persamaan Planck
Hampir selalu ada kebutuhan untuk berpindah dari satu kondisi reaksi ke kondisi reaksi lainnya. Untuk melakukan ini, Anda perlu mengetahui ketergantungan konstanta kesetimbangan pada suhu dan tekanan. Pengetahuan tentang konstanta kesetimbangan pada berbagai temperatur dan tekanan memperluas kemampuan ahli teknologi kimia dalam memprediksi hasil proses.
Ketergantungan konstanta kesetimbangan pada suhu diperoleh dengan membedakan isoterm reaksi terhadap suhu dengan syarat tekanan dalam kp tidak bergantung pada suhu
Kami mendapatkan ekspresinya

membagi semua suku persamaan ini dengan T, kita menyatakan suku tersebut melalui d∆G/dT. Mari kita substitusikan ke dalam ekspresi isoterm yang terdiferensiasi

Persamaan yang dihasilkan disebut isobar reaksi Van't Hoff. Pendekatan yang benar-benar identik digunakan untuk menurunkan isokore suatu reaksi, yang menggunakan perubahan energi Helmholtz, dan komposisi sistem dinyatakan dalam konsentrasi. Ekspresi isokore memiliki bentuk

dimana ∆Н dan ∆U adalah efek termal termodinamika.
Untuk memperoleh ketergantungan konstanta kesetimbangan pada tekanan, digunakan pendekatan yang sedikit berbeda. k P dan k s tidak bergantung pada tekanan. Dari hubungan antara konstanta kesetimbangan yang dinyatakan dengan berbagai cara (6), jelas bahwa konstanta k n bergantung pada tekanan: k n = k P ∙ P -∆ n
Mari kita ambil logaritma dari ekspresi ini dan kemudian membedakannya terhadap P:
Perhatikan bahwa d ln k р /d P = 0 dengan syarat; d ln P/d P = 1/P dari mana kita mendapatkan d ln ke N /d P = - ∆n/P; Kita mencari Δn dari persamaan Clapeyron-Mendeleev, menuliskannya untuk dua keadaan dalam bentuk PΔV = ΔnRT. Mari kita nyatakan ΔV dari sini dan substitusikan ke dalam ekspresi terdiferensiasi dari konstanta kesetimbangan
k n , kita memperoleh persamaan Planck, yang menyatakan ketergantungan konstanta kesetimbangan pada tekanan
Persamaan isokore, isobar reaksi, dan persamaan Planck memiliki nilai prediktif dan sangat menarik bagi para ahli teknologi. Persamaan ini merupakan ciri kuantitatif dari prinsip pergeseran kesetimbangan Le Chatelier. Prinsip ini dapat dirumuskan sebagai berikut: “Jika suatu sistem dalam keadaan setimbang dipengaruhi dari luar, sehingga mengubah salah satu kondisi yang menentukan posisi setimbang, maka suatu arah dalam sistem akan menguat, akibatnya pengaruh luar akan melemah, dan posisi setimbang akan bergeser ke dalam. arah yang sama." Seringkali, kondisi yang menentukan posisi kesetimbangan adalah suhu, tekanan, dan konsentrasi.
Mari kita ilustrasikan signifikansi prediktif persamaan turunan sebagai karakteristik kuantitatif dari prinsip pergeseran kesetimbangan menggunakan contoh sintesis amonia: N 2 + 3H 2 ↔ 2NH 3 - ∆H

Mari kita tulis persamaan isobar
Misalkan sistem ini dipanaskan sebesar ΔH<0. Правая часть уравнения изотермы уменьшится (∆Н/RT 2)<0, значит левая часть тоже уменьшится: (d ln к р /d P)<0 (она может уменьшиться за счет уменьшения к р).

Tetapan kesetimbangan sintesis amonia berbentuk She
dapat menurun karena penurunan tekanan produk reaksi dan peningkatan tekanan zat awal. Artinya ketika dipanaskan, reaksi eksotermik ini bergeser ke arah proses penguraian amonia secara endotermik. Hasil ini diperoleh berdasarkan analisis isobar Van't Hoff. Mudah untuk menunjukkan bahwa hal tersebut sesuai dengan prediksi prinsip Le Chatelier. Hasil serupa dapat diperoleh dengan menerapkan persamaan Planck pada analisis reaksi ini, dengan memperhitungkan bahwa tekanan P adalah kebalikan dari 1/V volume. Siswa diminta melakukan tindakan tersebut secara mandiri.
Ketergantungan konstanta kesetimbangan reaksi terhadap suhu dapat dijelaskan dengan persamaan isobar reaksi kimia (isobar van't Hoff):
dan isokores reaksi kimia (isokores van't Hoff):
![]()
Di sini Δ H dan Δ kamu- efek termal dari suatu reaksi yang terjadi, masing-masing, pada tekanan konstan atau volume konstan. Jika Δ H> 0 (efek termal positif, reaksi endotermik), maka koefisien suhu konstan
kesetimbangan juga positif, yaitu dengan meningkatnya suhu, konstanta kesetimbangan reaksi endotermik meningkat, kesetimbangan bergeser ke kanan (yang cukup sesuai dengan prinsip Le Chatelier).
Konstanta kesetimbangan dan konstanta laju reaksi
Untuk reaksi kimia reversibel, konstanta kesetimbangan dapat dinyatakan dalam konstanta laju reaksi maju dan mundur, berdasarkan fakta bahwa dalam kesetimbangan laju reaksi maju dan mundur adalah sama. Misalnya, untuk reaksi kimia dasar reversibel orde pertama
mudah untuk menunjukkan bahwa:
Di mana k 1 adalah konstanta laju reaksi maju, dan k 2 - balik. Hubungan penting ini menyediakan salah satu “titik kontak” antara kinetika kimia dan termodinamika kimia.
Metode untuk menghitung konstanta kesetimbangan
Metode perhitungan untuk menentukan konstanta kesetimbangan suatu reaksi biasanya dilakukan dengan menghitung perubahan standar energi Gibbs selama reaksi ( ΔG 0 ), dan kemudian menggunakan rumus:
Perlu diingat bahwa energi Gibbs merupakan fungsi dari keadaan sistem, yaitu tidak bergantung pada jalur proses, pada mekanisme reaksi, tetapi hanya ditentukan oleh keadaan awal dan akhir sistem. . Oleh karena itu jika langsung ditentukan atau dihitung ΔG 0 karena beberapa reaksi sulit dilakukan karena alasan tertentu, Anda dapat memilih reaksi antara yang mana ΔG 0 diketahui atau dapat ditentukan dengan mudah, dan penjumlahannya akan menghasilkan reaksi yang dimaksud (lihat Hukum Hess). Secara khusus, reaksi pembentukan senyawa dari unsur sering digunakan sebagai reaksi antara.
Perhitungan entropi perubahan energi Gibbs dan konstanta kesetimbangan reaksi
Metode perhitungan entropi ΔG reaksi adalah salah satu yang paling umum dan nyaman. Hal ini didasarkan pada hubungan:
atau, karenanya, untuk standar Perubahan energi Gibbs:
Di Sini ΔH 0 pada tekanan dan suhu konstan sama dengan efek termal reaksi, metode perhitungan dan penentuan eksperimentalnya diketahui - lihat, misalnya, persamaan Kirchhoff:
![]()
Hal ini diperlukan untuk mendapatkan perubahan entropi selama reaksi. Masalah ini dapat diatasi dengan beberapa cara, misalnya:
Menurut data termal - berdasarkan teorema termal Nernst dan menggunakan informasi tentang ketergantungan kapasitas panas pada suhu peserta reaksi. Misalnya, untuk zat yang berwujud padat pada kondisi normal:
![]()
dimana S 0 = 0 (postulat Planck) dan kemudian, dengan demikian,
![]() .
.
(di sini indeks sol berasal dari bahasa Inggris solid). Pada suhu tertentu T:
![]()
Untuk zat yang berbentuk cair atau gas pada suhu normal, atau, lebih umum, untuk zat yang mengalami transisi fasa dalam kisaran suhu dari 0 (atau 298) hingga T, perubahan entropi yang terkait dengan transisi fase ini harus diperhitungkan. .
Untuk gas ideal - dengan metode statistik kuantum.
Dengan menggunakan berbagai metode empiris dan semi-empiris, sejumlah kecil data awal seringkali cukup untuk melakukan hal ini. Misalnya, untuk zat anorganik padat, entropi dapat diperkirakan dengan menggunakan rumus
dimana A dan B adalah konstanta tabel bergantung pada jenis senyawa yang dimaksud, M adalah berat molekul.
Jadi, jika , dan ketergantungan kapasitas panas pada suhu diketahui, maka dapat dihitung dengan menggunakan rumus:
Versi yang agak disederhanakan dari rumus ini diperoleh dengan mempertimbangkan jumlah kapasitas panas suatu zat tidak bergantung pada suhu dan sama dengan jumlah kapasitas panas pada 298 K:
Dan perhitungan yang lebih sederhana dilakukan dengan menyamakan jumlah kapasitas panas dengan nol:
Transisi dari ke konstanta kesetimbangan dilakukan sesuai dengan rumus di atas.
Prinsip Le Chatelier-Brown(1884) - jika suatu sistem yang berada dalam keseimbangan stabil dipengaruhi dari luar, mengubah salah satu kondisi keseimbangan (suhu, tekanan, konsentrasi), maka proses dalam sistem yang bertujuan untuk mengkompensasi pengaruh eksternal akan meningkat.
Henri Le Chatelier (Prancis) merumuskan prinsip termodinamika keseimbangan bergerak ini, yang kemudian digeneralisasikan oleh Karl Braun
Mari kita perhatikan reaksi kebalikannya secara umum
Studi eksperimental menunjukkan bahwa dalam keadaan setimbang, hubungan berikut ini berlaku:

(tanda kurung siku menunjukkan konsentrasi). Hubungan di atas adalah ekspresi matematis dari hukum aksi massa, atau hukum kesetimbangan kimia, yang menurutnya, dalam keadaan kesetimbangan kimia pada suhu tertentu, produk konsentrasi produk reaksi dalam pangkat, eksponen
yang sama dengan koefisien yang sesuai dalam persamaan reaksi stoikiometri, dibagi dengan produk serupa dari konsentrasi reaktan dalam pangkat yang sesuai, mewakili nilai konstan. Konstanta ini disebut konstanta kesetimbangan. Ekspresi konstanta kesetimbangan dalam konsentrasi produk dan reagen merupakan ciri khas reaksi dalam larutan.
Perhatikan bahwa sisi kanan persamaan konstanta kesetimbangan hanya berisi konsentrasi zat terlarut. Ini tidak boleh mencakup istilah apa pun yang berkaitan dengan padatan murni, cairan murni, atau pelarut yang ikut serta dalam reaksi, karena istilah-istilah ini konstan.
Untuk reaksi yang melibatkan gas, konstanta kesetimbangan dinyatakan dalam tekanan parsial gas, dan bukan dalam konsentrasinya. Dalam hal ini, konstanta kesetimbangan dilambangkan dengan simbol.
Konsentrasi gas dapat dinyatakan dalam tekanannya menggunakan persamaan keadaan gas ideal (lihat Bagian 3.1):
Dari persamaan ini berikut ini
dimana adalah konsentrasi gas, yang dapat dilambangkan sebagai [gas]. Karena - adalah nilai konstan, kita dapat menuliskannya pada suhu tertentu
Mari kita nyatakan konstanta kesetimbangan reaksi antara hidrogen dan yodium dalam bentuk tekanan parsial gas-gas ini.
Persamaan reaksi ini berbentuk
Oleh karena itu, konstanta kesetimbangan reaksi ini diberikan oleh
![]()
Perhatikan bahwa konsentrasi atau tekanan parsial produk, yaitu zat yang ditunjukkan di sisi kanan persamaan kimia, selalu menjadi pembilangnya, dan konsentrasi atau tekanan parsial reaktan, yaitu zat yang ditunjukkan di sisi kiri persamaan kimia. persamaan, selalu bentuk penyebut persamaan konstanta kesetimbangan.
Satuan pengukuran konstanta kesetimbangan
Konstanta kesetimbangan dapat berupa besaran berdimensi atau tak berdimensi, bergantung pada jenis ekspresi matematikanya. Pada contoh di atas, konstanta kesetimbangan merupakan besaran tak berdimensi karena pembilang dan penyebut suatu pecahan mempunyai dimensi yang sama. Jika tidak, konstanta kesetimbangan memiliki dimensi yang dinyatakan dalam satuan konsentrasi atau tekanan.
Berapakah besar tetapan kesetimbangan reaksi berikut?
Oleh karena itu, ia memiliki dimensi (mol-dm-3)

Jadi, dimensi konstanta kesetimbangan yang dipertimbangkan adalah atau dm3/mol.
Berapakah besar tetapan kesetimbangan reaksi berikut?

Konstanta kesetimbangan reaksi ini ditentukan oleh ekspresi
Oleh karena itu, ia memiliki dimensi
![]()

Jadi, dimensi konstanta kesetimbangan tersebut adalah: atm atau Pa.
Kesetimbangan heterogen
Sejauh ini kita hanya memberikan contoh kesetimbangan homogen. Misalnya, dalam reaksi sintesis hidrogen iodida, produk dan kedua reaktan berada dalam bentuk gas.
Sebagai contoh reaksi yang mengarah ke kesetimbangan heterogen, perhatikan disosiasi termal kalsium karbonat
Konstanta kesetimbangan reaksi ini diberikan oleh
![]()
Perhatikan bahwa ungkapan ini tidak mencakup istilah apa pun yang berkaitan dengan dua padatan yang terlibat dalam reaksi. Dalam contoh yang diberikan, konstanta kesetimbangan mewakili tekanan disosiasi kalsium karbonat. Hal ini menunjukkan bahwa jika kalsium karbonat dipanaskan dalam bejana tertutup, maka tekanan disosiasinya pada suhu tetap tidak bergantung pada jumlah kalsium karbonat. Pada bagian selanjutnya, kita akan mempelajari bagaimana konstanta kesetimbangan berubah terhadap suhu. Dalam contoh yang dibahas, tekanan disosiasi melebihi 1 atm hanya pada suhu yang lebih tinggi sehingga dioksida menjadi lebih tinggi
Baiklah, kita mulai langsung ke intinya. Anda seharusnya sudah memahami apa itu variabel dan bagaimana menggunakan kondisi dalam program Anda. Saya harap demikian, jika tidak, semua hal lainnya tidak ada gunanya untuk Anda baca.
Ketika saya berbicara tentang variabel, saya mengabaikan satu jenis variabel lagi. Variabel ini, tidak seperti variabel lainnya, menyimpan nilainya selama eksekusi program. Ini dimulai setelah deklarasi dan tidak dapat diubah dalam kode selanjutnya. Variabel ini disebut konstan.
Untuk apa konstanta? Untuk menyimpan informasi permanen. Meskipun saya tidak ingin memberikan perbandingan matematis, itu adalah perbandingan yang paling jelas. Ingat fisika - konstanta gravitasi, suhu dalam Kelvin, Fahrenheit, dll. Semua ini adalah konstanta. Faktanya, kita pernah mendeklarasikan variabel seperti itu dan melupakan maknanya, mengganti namanya ke dalam program. Anda mungkin bertanya, mengapa Anda tidak bisa menggunakan variabel sederhana untuk menyimpan informasi seperti itu? Tetapi karena Anda dapat menetapkan nilai yang berbeda ke variabel ini, tetapi tidak ke konstanta.
Mari kita lihat sintaksnya, lalu saya akan memberikan contoh visual.
Di C, konstanta ditentukan oleh direktif # mendefinisikan
#define PI 3.14 // PI sekarang akan berisi 3.14
Petunjuk ini dapat ditemukan di banyak program saat ini, namun pendekatan ini sudah ketinggalan jaman. Pengubah baru telah diperkenalkan di C++ konstanta.
Konstanta float PI=3,14;\
Konstanta float PI=3,14; int _tmain(int argc, _TCHAR* argv) ( setlocale(0,""); //mengatur bahasa default (Rusia) int S,R=21; //luas dan jari-jari lingkaran S=PI*R*R ; system("pause"); //untuk mencegah jendela ditutup return 0;
Dimanapun kita menyebut variabel ini, dimanapun variabelnya akan sama dengan 3,14. Sangat nyaman, bukan? Omong-omong, demi eksperimen, cobalah memberikan beberapa nilai pada PI dalam program. Lihat bagaimana kompiler bereaksi.
Sebagai kesimpulan, mengenai konstanta, saya dapat mengatakan bahwa Anda dapat menggunakan ekspresi aritmatika sebagai konstanta.
Konstan PROIZV=23*12; // sekarang kita punya angka 276 dalam konstanta
Juga, ingat satu aturan - Nama tetap harus selalu ditulis dengan huruf kapital! Ini juga akan membuat hidup Anda lebih mudah, karena ketika Anda menemukan konstanta yang diformat dengan benar, Anda akan segera memahami bahwa itu adalah sebuah konstanta.
Selain konstanta, mereka banyak digunakan dalam pemrograman transfer. Pada intinya, ini adalah sekumpulan konstanta. Mereka diperlukan untuk membatasi rentang nilai variabel. Ini bisa berupa hari dalam seminggu, bulan, jenis kelamin (suami atau istri), dll. Enumerasi terutama banyak digunakan dalam penulisan permainan.
Baiklah, sekarang mari kita lupakan apa yang saya tulis di atas dan lihat enumerasinya sebagai contoh.
Pencacahan harus dideklarasikan di luar fungsi utama. Intinya adalah ini adalah tipe yang ditentukan oleh programmer. Dan tipe seperti itu, bersama dengan struktur dan kelas, harus dideklarasikan, sebaiknya dalam modul terpisah. Tapi kita akan melihat semua ini nanti. Berikut cara pencacahannya dinyatakan:
enum Bulan (Jan, Feb, Marth, April, Mei, Juni, Jule, Agustus, Sept, Okt, Nov, Des);
Pencacahannya diawali dengan kata kunci enum, kemudian nama pencacahannya ( ini bukan variabel!!!), dan kumpulan nilai ditunjukkan dalam tanda kurung.
Sekarang kita dapat menggunakan tipe yang dideklarasikan dalam program kita:
Int main() ( Bulan curMonth=Juni; // sekarang //Juli disimpan dalam variabel curMonth)
Menurut Anda apa yang disimpan dalam variabel curMonth? Kalau kamu mengira ini bulan Juni, kamu salah. Pencacahan adalah tipe numerik dan secara implisit dimasukkan ke int. Penomorannya dimulai dari 0. Mengetahui hal ini, kita dapat berasumsi bahwa curMonth berisi angka 5. Dengan kata lain, kita dapat menetapkan variabel ini, alih-alih nama bulan, analog numeriknya dalam interpretasi enumerasi dan kita akan benar.
Tentu saja, contoh bulan atau hari dalam seminggu tidak begitu jelas. Namun, Anda harus memahami bahwa suatu variabel dapat dibatasi pada rentang nilai. Cobalah, tetapkan curMonth nilai selain enum dan lihat apa yang dipanggil kompiler J kepada Anda.
Namun dalam pemrograman, misalnya di Windows, kita akan sering menjumpai enumerasi dan konstanta. Di sinilah Anda akan memahami sepenuhnya kenyamanan menggunakannya.
Sekarang mari kembali ke contoh kita dan lihat apa lagi yang bisa kita ubah. Kita menghitung bulan dari satu, bukan dari nol. Dari kode kami Anda dapat melihat bahwa 100 Juni diberi nilai 5, bukan 6. Nah, Anda dapat mengatur penomoran Anda sendiri dalam pencacahannya.
Saya secara eksplisit menetapkan Jan nilai 1. Kompiler sendiri akan menetapkan nilai yang diperlukan untuk bulan-bulan yang tersisa. Tentu saja, Anda dapat melakukan semuanya secara manual, tetapi tidak ada gunanya melakukannya.
Dan akhirnya. Variabel juga dapat dideklarasikan saat menentukan enumerasi:
Bulan Enum (Jan=1, Feb, Marth,April, Mei, Juni, Jule, Agustus, Sep, Okt, Nov, Des) Bulan ini;
Maka variabel ini sudah dapat digunakan dalam program. Anda dapat mengumumkan banyak hal di sana. Namun secara pribadi, saya kurang menyukai cara ini, mengingat agak membingungkan. Lagi pula, kita memprogram bukan dalam C, tetapi dalam C++.
Pemeran
Baca di sini dengan seksama. Faktanya adalah C++ terkenal dengan kesalahan aritmatikanya dalam perhitungan. Tidak, dia menghitung semuanya dengan benar, tetapi hasil perhitungannya sangat bergantung pada jenis variabelnya. Seorang programmer yang memutuskan untuk menetapkan hasil bagi pembagian untuk mengetik int mungkin sering kali tidak mendapatkan hasil yang diinginkan. Faktanya adalah kompiler bahasa melakukan konversi tipe implisit.
Berikut ini contohnya. Kita perlu menghitung gaji karyawan. Kami tahu tarif per jamnya. Kemudian kita mengalikan nilai ini dengan jumlah jam kerja dan mendapatkan hasil yang diinginkan. Semuanya sederhana di sini. Tapi bayangkan seorang direktur yang mempekerjakan seorang karyawan dan tidak tahu berapa gajinya. Kemudian dia mengambil gaji daerah dan membaginya dengan jumlah jam kerja.
Int zarp, jam, vel; kecepatan=22320; // gaji di kota adalah 22.320 rubel jam=22*8; //jumlah jam adalah 22 hari kerja * 8 jam hari kerja zarp=vel / jam; // hitungan jam kita<<"Час работника стоит =" < Program ini akan memberi kita angka 126 rubel. Ini cocok untuk kita, tetapi mudah untuk mengambil kalkulator dan menghitung bahwa sebenarnya angka tersebut adalah 126,8 Dan jika karyawan tidak tersinggung dengan kekurangan ini, maka kesalahan seperti itu dalam perhitungan tidak dapat diterima. Apa yang telah terjadi? zarp adalah bilangan bulat dan hanya menyimpan nilai bilangan bulat. Bagian pecahannya akan dibuang. Dengan kata lain, perlu menggunakan tipe ganda, yang akan menyimpan pecahan. Namun di sini situasinya agak lebih menarik. Kompiler untuk sementara menetapkan tipe ganda ke variabel jam dan vel, seolah-olah memperluas maknanya. Kita mungkin tidak menyadarinya, padahal penting untuk dipahami. Kompilator, ketika menemukan tipe yang lebih besar, menugaskan operannya ke tipe yang lebih kecil. Itu semua aturannya. Namun, bayangkan situasi di mana seorang programmer paranoid membuang-buang memori dengan sia-sia (ingatkah Anda bahwa tipe double 2 kali lebih besar dari int?) dan mencoba untuk menetapkan tipe ini di mana saja. Ya, itu mendapatkan nilai yang tepat, mengorbankan beberapa kinerja (operasi dengan tipe pecahan lebih lambat dibandingkan dengan tipe bilangan bulat, tetapi ini tidak lagi relevan), tetapi Anda secara artifisial membuat diri Anda terpojok. Mari kita kembali ke direktur kita, yang masih belum tahu berapa yang harus dia bayar untuk pekerjaannya. Katakanlah seorang akuntan yang teliti memberinya nilai per jam sebesar 132,12 rubel. Anda akan segera memberinya nilai ganda, mulai menghitung, dan melolong ketika uang muncul di mana-mana. Ya, kita tidak perlu memberikannya kepada karyawan! Dalam hal ini, jika Anda melakukan kesalahan seperti itu, Anda dapat membuat pemeran yang eksplisit. Di C itu dilakukan seperti ini: ekspresi (tipe pemeran).
(int)vel; // mengonversi tipe secara artifisial menjadi bilangan bulat. Di C++, Stroupstrup memperkenalkan transformasi baru. Berikut uraiannya: statis
_
pemeran
<тип>(ekspresi)
Transformasi dianggap sebagai tanda selera pemrograman yang buruk. Jika Anda memiliki terlalu banyak konversi, kemungkinan besar Anda perlu mengubah semua nilai dalam program. Namun, transformasi sering digunakan dalam OOP. Kami tidak akan membahasnya untuk saat ini, dengan latihan Anda akan segera memahami semuanya. Jadi, istirahatlah. Pelajaran berikutnya akan lebih sulit dan lebih penting. Saya segera menyenangkan Anda - ada beberapa pelajaran yang tersisa dari yayasan ini dan kami akan memulai pemrograman normal.