التوازن الكيميائي هو حالة من التفاعل الكيميائي العكسي.
أأ+ بب= جج+ دد،
حيث لا يتغير تركيز المواد المتفاعلة في خليط التفاعل مع مرور الوقت. تتميز حالة التوازن الكيميائي ثابت التوازن الكيميائي:
أين ج ط- تركيز المكونات في حالة توازنخليط مثالي.
يمكن أيضًا التعبير عن ثابت التوازن بدلالة الكسور المولية للتوازن العاشر طعناصر:
بالنسبة للتفاعلات التي تحدث في الطور الغازي، من المناسب التعبير عن ثابت التوازن بدلالة ضغوط التوازن الجزئية بايعناصر:
للغازات المثالية باي = ج ط ر.تو باي = اكس اي بي، أين صهو الضغط الكلي، وبالتالي ك.ب, ك جو ك اكسترتبط بالعلاقة التالية:
K P = K C (RT) c+d–a–b = K X P c+d–a–b. (9.4)
ويرتبط ثابت التوازن ص جس التفاعل الكيميائي:
![]() (9.5)
(9.5)
![]() (9.6)
(9.6)
يتغير ص جأو الترددات اللاسلكيةفي تفاعل كيميائي عند ضغوط جزئية معينة (ليست بالضرورة متوازنة). بايأو التركيزات ج طيمكن حساب المكونات باستخدام المعادلة تساوي حرارة التفاعل الكيميائي (متساوي الحرارة فان هوف):
 . (9.7)
. (9.7)
 . (9.8)
. (9.8)
وفق مبدأ لو شاتيليهإذا تم تأثير تأثير خارجي على نظام في حالة توازن، فإن التوازن سوف ينحرف بحيث يقلل من تأثير التأثير الخارجي. وبالتالي، فإن زيادة الضغط تؤدي إلى تحول التوازن نحو انخفاض في عدد جزيئات الغاز. إن إضافة أي مكون من مكونات التفاعل إلى خليط التوازن يؤدي إلى إزاحة التوازن نحو انخفاض كمية هذا المكون. تؤدي الزيادة (أو النقصان) في درجة الحرارة إلى تحويل التوازن نحو التفاعل الذي يحدث مع امتصاص (إطلاق) الحرارة.
يتم وصف الاعتماد الكمي لثابت التوازن على درجة الحرارة بالمعادلة إيزوبار التفاعل الكيميائي (فانت هوف الأيزوبار)
![]() (9.9)
(9.9)
و ايزوشورات التفاعل الكيميائي (فان هوف isochores)
![]() . (9.10)
. (9.10)
تكامل المعادلة (9.9) على افتراض أن ص حالتفاعل لا يعتمد على درجة الحرارة (وهذا صحيح في نطاقات درجات الحرارة الضيقة)، ويعطي:
![]() (9.11)
(9.11)
![]() (9.12)
(9.12)
أين ج –ثابت التكامل وهكذا فإن الاعتماد على ln كف من 1 /تيجب أن يكون خطيًا، وميل الخط المستقيم هو - ص ح/ر.
التكامل داخل ك 1 , ك 2 و ت 1, ت 2 يعطي:
 (9.13)
(9.13)
 (9.14)
(9.14)
وباستخدام هذه المعادلة، بمعرفة ثوابت التوازن عند درجتي حرارة مختلفتين، يمكننا الحساب ص حتفاعلات. وبناء على ذلك، معرفة ص حالتفاعلات وثابت التوازن عند درجة حرارة معينة، يمكنك حساب ثابت التوازن عند درجة حرارة أخرى.
أمثلة
CO(ز) + 2H2 (جم) = CH3OH(g)
عند 500 ك. و ز سبالنسبة لـ CO(g) وCH 3 OH(g) عند 500 K تساوي –155.41 كيلوجول. مول –1 و –134.20 كيلوجول. مول -1 على التوالي.
حل. يذهبتفاعلات:
ص ز س= و ز س(CH3أوه) – و ز س(CO) = -134.20 - (-155.41) = 21.21 كيلوجول. مول -1 .
![]() = 6.09 10 –3 .
= 6.09 10 –3 .
مثال 9-2. ثابت توازن التفاعل
يساوي ك P = 1.64 10 –4 عند 400 درجة مئوية. ما الضغط الإجمالي الذي يجب تطبيقه على خليط متساوي الأقطاب من N 2 وH 2 بحيث يتحول 10% من N 2 إلى NH 3؟ تعتبر الغازات مثالية.
حل. دع مولًا من N 2 يتفاعل. ثم
| ن 2 (ز) | + | 3 ح 2 (ز) | = | 2NH 3 (ز) | |
| الكمية الأصلية | 1 | 1 | |||
| كمية التوازن | 1– | 1–3 | 2 (المجموع: 2-2) | ||
| الكسر المولي المتوازن: |
لذلك، كس =  و ك ف = ك س . ص –2
=
و ك ف = ك س . ص –2
=  .
.
بالتعويض بـ = 0.1 في الصيغة الناتجة، نحصل على ذلك
1.64 10 –4 = ، أين ص= 51.2 أجهزة الصراف الآلي.
، أين ص= 51.2 أجهزة الصراف الآلي.
مثال 9-3. ثابت توازن التفاعل
CO(ز) + 2H2 (جم) = CH3OH(g)
عند 500 كلفن يساوي كف = 6.09 10 –3 . تم تسخين خليط التفاعل المتكون من 1 mol CO و 2 mol H 2 و 1 mol من الغاز الخامل (N 2) إلى درجة حرارة 500 K وضغط إجمالي قدره 100 atm. احسب تكوين خليط التوازن.
حل. دع مولًا من ثاني أكسيد الكربون يتفاعل. ثم
| ثاني أكسيد الكربون (ز) | + | 2H 2 (ز) | = | CH3OH(ز) | |
| الكمية الأصلية: | 1 | 2 | 0 | ||
| كمية التوازن: | 1– | 2–2 | |||
| المجموع في خليط التوازن: | 3-2 مول من المكونات + 1 مول ن 2 = 4-2 مول | ||||
| الكسر المولي المتوازن | |||||
لذلك، كس =  و ك ف = ك س . ف-2 =
و ك ف = ك س . ف-2 = ![]() .
.
وبالتالي 6.09 10 –3 = ![]() .
.
وبحل هذه المعادلة نحصل على = 0.732. وعليه فإن الكسور المولية للمواد الموجودة في خليط التوازن تساوي: = 0.288، = 0.106، = 0.212، = 0.394.
مثال 9-4. لرد الفعل
N 2 (جم) + 3H2 (جم) = 2NH3 (جم)
عند 298 ك كف = 6.0 10 5 , أ و ح س(NH 3) = -46.1 كيلوجول. مول -1 . قدر قيمة ثابت التوازن عند 500 K.
حل. الإنثالبي المولي القياسي للتفاعل هو
ص ح س= 2و ح س(NH 3) = -92.2 كيلوجول. مول -1 .
ووفقا للمعادلة (9.14)، 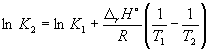 =
=
لين (6.0 10 5) + ![]() = -1.73، من أين ك 2 =
0.18.
= -1.73، من أين ك 2 =
0.18.
لاحظ أن ثابت التوازن للتفاعل الطارد للحرارة يتناقص مع زيادة درجة الحرارة، وهو ما يتوافق مع مبدأ لو شاتيليه.
مهام
- عند درجة حرارة 1273 كلفن وضغط إجمالي 30 atm في خليط متوازن
- عند درجة حرارة 2000 درجة مئوية وضغط إجمالي قدره 1 ATM، يتفكك 2% من الماء إلى هيدروجين وأكسجين. احسب ثابت التوازن للتفاعل
- ثابت توازن التفاعل
- ثابت توازن التفاعل
- تم تسخين وعاء سعة 3 لتر يحتوي على 1.79 10 –2 مول I 2 إلى درجة حرارة 973 K. وتبين أن الضغط في الوعاء عند التوازن يساوي 0.49 atm. بافتراض أن الغازات مثالية، احسب ثابت التوازن عند 973 K للتفاعل
- لرد الفعل
- لرد الفعل
- تم تسخين وعاء سعة 1 لتر يحتوي على 0.341 مول PCl 5 و0.233 مول N 2 إلى 250 درجة مئوية. وتبين أن الضغط الإجمالي في الوعاء عند التوازن يبلغ 29.33 atm. بافتراض أن جميع الغازات مثالية، احسب ثابت التوازن عند 250 درجة مئوية للتفاعل الذي يحدث في الوعاء
- ثابت توازن التفاعل
- عند 25 درجة مئوية و ز س(NH 3) = -16.5 كيلوجول. مول -1 . احسب ص جتفاعلات تكوين NH 3 عند ضغوط جزئية من N 2 و H 2 و NH 3 تساوي 3 atm و 1 atm و 4 atm على التوالي. في أي اتجاه سيسير التفاعل تلقائيًا في ظل هذه الظروف؟
- تفاعل طارد للحرارة
- ثابت التوازن لتفاعل الطور الغازي لأيزوميرة البورنيول (C 10 H 17 OH) إلى الإيزوبورنيول هو 0.106 عند 503 كلفن. تم وضع خليط من 7.5 جم من البورنيول و14.0 جم من الإيزوبورنيول في وعاء سعة 5 لتر وحفظه. عند 503 كلفن حتى يتم تحقيق التوازن. احسب الكسور المولية وكتل البورنيول والإيزوبورنيول في خليط التوازن.
- التوازن في رد الفعل
- احسب الضغط الإجمالي الذي يجب تطبيقه على خليط مكون من 3 أجزاء H 2 وجزء واحد N 2 للحصول على خليط متوازن يحتوي على 10% NH 3 من حيث الحجم عند 400 درجة مئوية. ثابت التوازن للتفاعل
- عند درجة حرارة 250 درجة مئوية وضغط إجمالي قدره 1 atm، يتم فصل PCl 5 بنسبة 80% بواسطة التفاعل
- عند 2000 درجة مئوية للتفاعل
- احسب المحتوى الحراري القياسي للتفاعل الذي يكون فيه ثابت التوازن
أ) يزيد بمقدار مرتين، ب) يتناقص بمقدار مرتين عندما تتغير درجة الحرارة من 298 كلفن إلى 308 كلفن. - يتم وصف اعتماد ثابت التوازن للتفاعل 2C 3 H 6 (g) = C 2 H 4 (g) + C 4 H 8 (g) على درجة حرارة تتراوح بين 300 K و 600 K بالمعادلة
CO 2 (جم) + C(tv) = 2CO(g)
يحتوي على 17% (من حيث الحجم) CO 2 . ما النسبة المئوية لثاني أكسيد الكربون التي سيحتويها الغاز عند ضغط إجمالي قدره 20 atm؟ عند أي ضغط سيحتوي الغاز على 25% CO 2؟
H 2 O (g) = H 2 (g) + 1/2O 2 (g) في ظل هذه الظروف.
CO(ز) + H2O(g) = CO 2 (جم) + H2 (جم)
عند 500 درجة مئوية متساوية ك ص= 5.5. تم تسخين خليط يتكون من 1 mol CO و 5 mol H 2 O إلى درجة الحرارة هذه. احسب الكسر المولي لـ H2O في خليط التوازن.
ن 2 أو 4 (جم) = 2NO 2 (جم)
عند 25 درجة مئوية متساوية ك ص= 0.143. احسب الضغط الذي سيتم إنشاؤه في وعاء بحجم 1 لتر، حيث تم وضع 1 جم من N 2 O 4 عند درجة الحرارة هذه.
أنا 2 (ز) = 2أنا (ز).
عند 250 درجة مئوية ص جس = –2508 جول مول –1. عند أي ضغط إجمالي ستكون درجة تحويل PCl 5 إلى PCl 3 وCl 2 عند 250 درجة مئوية 30%؟
2HI(ز) = ح 2 (ز) + أنا 2 (ز)
توازن ثابت ك P = 1.83 10 –2 عند 698.6 K. ما عدد جرامات HI التي تتكون عند تسخين 10 g من I 2 و0.2 g من H 2 إلى درجة الحرارة هذه في وعاء سعة ثلاثة لترات؟ ما هي الضغوط الجزئية لـ H 2 وI 2 وHI؟
PCl 5 (g) = PCl 3 (g) + Cl 2 (g)
CO(ز) + 2H2 (جم) = CH3OH(g)
عند 500 كلفن يساوي كف = 6.09 10 –3 . احسب الضغط الإجمالي المطلوب لإنتاج الميثانول بإنتاجية 90% إذا تم أخذ CO وH2 بنسبة 1:2.
CO(ز) + 2H2 (جم) = CH3OH(g)
في حالة توازن عند 500 كلفن و10 بار. إذا كانت الغازات مثالية، فكيف ستؤثر العوامل التالية على إنتاج الميثانول: أ) الزيادة ت; ب) الترويج ص; ج) إضافة غاز خامل في الخامس= ثابت؛ د) إضافة غاز خامل في ص= ثابت؛ ه) إضافة H 2 في ص= ثابت؟
2NOCl(g) = 2NO(g) + Cl2(g)
تم ضبطه عند 227 درجة مئوية وضغط إجمالي قدره 1.0 بار عندما يكون الضغط الجزئي لـ NOCl 0.64 بار (في البداية كان NOCl فقط موجودًا). احسب ص ز سلرد الفعل. عند أي ضغط إجمالي سيكون الضغط الجزئي لـ Cl 2 مساويًا لـ 0.10 بار؟
N 2 (جم) + 3H2 (جم) = 2NH3 (جم)
عند 400 درجة مئوية يساوي ك = 1.60 10 –4 .
PCl 5 (g) = PCl 3 (g) + Cl 2 (g).
ما هي درجة تفكك PCl 5 إذا أضيف N 2 إلى النظام بحيث يكون الضغط الجزئي للنيتروجين 0.9 atm؟ يتم الحفاظ على الضغط الكلي عند 1 ATM.
N 2 (ز) + O 2 (ز) = 2NO (ز)
ك ع = 2.5 10 –3 . خليط متوازن من N 2، O 2، NO وغاز خامل عند ضغط إجمالي قدره 1 بار يحتوي على 80٪ (من حيث الحجم) N 2 و 16٪ O 2. ما هي النسبة المئوية من حيث الحجم لا؟ ما هو الضغط الجزئي للغاز الخامل؟
ln ك = –1.04 –1088 /ت +1.51 10 5 /ت 2 .
معادلات إيزوبار، إيزوشور، تفاعلات فانت هوف ومعادلة بلانك
دائمًا ما تكون هناك حاجة للانتقال من ظروف رد الفعل إلى ظروف أخرى. للقيام بذلك، تحتاج إلى معرفة اعتماد ثوابت التوازن على درجة الحرارة والضغط. إن معرفة ثوابت التوازن عند درجات الحرارة والضغوط المختلفة توسع من قدرات التقني الكيميائي في التنبؤ بنتائج العملية.
يتم الحصول على اعتماد ثابت التوازن على درجة الحرارة عن طريق اشتقاق درجة حرارة التفاعل بالنسبة لدرجة الحرارة بشرط أن تكون الضغوط بوحدة kp مستقلة عن درجة الحرارة
نحصل على التعبير

بتقسيم جميع شروط هذه المعادلة على T، نعبر عن الحد من خلال d∆G/dT. لنعوض به في التعبير المتمايز للأيسوثرم

تسمى المعادلة الناتجة إيزوبار تفاعل فانت هوف. يتم استخدام نهج مماثل تمامًا لاشتقاق تساوي التفاعل، حيث يتم استخدام التغير في طاقة هيلمهولتز، ويتم التعبير عن تكوين النظام من حيث التركيزات. التعبير isochore له النموذج

حيث ∆Н و ∆U عبارة عن تأثيرات حرارية ديناميكية حرارية.
من أجل الحصول على اعتماد ثابت التوازن على الضغط، يتم استخدام نهج مختلف قليلا. k P و k s لا يعتمدان على الضغط. من العلاقة بين ثوابت التوازن معبراً عنها بطرق مختلفة (6)، يتضح أن الثابت k n يعتمد على الضغط: k n = k P ∙ P -∆ n
لنأخذ لوغاريتم هذا التعبير ثم نفرقه بالنسبة إلى P:
لاحظ أن d ln k Р /d P = 0 حسب الشرط؛ d ln P/d P = 1/P من حيث نصل d ln إلى N /d P = - ∆n/P; نجد Δn من معادلة Clapeyron-Mendeleev، ونكتبها لحالتين بالصيغة PΔV = ΔnRT. دعونا نعبر عن ΔV من هنا ونعوض به في التعبير التفاضلي لثابت التوازن
k n نحصل على معادلة بلانك التي تعبر عن اعتماد ثابت التوازن على الضغط
إن المعادلات المتساوية، وإيزوبار التفاعل، ومعادلة بلانك لها قيمة تنبؤية وهي ذات أهمية كبيرة للتقنيين. هذه المعادلات هي خاصية كمية لمبدأ تحول التوازن لوشاتيلييه. ويمكن صياغة هذا المبدأ على النحو التالي: "إذا تأثر نظام في حالة توازن من الخارج، فتغير أي من الشروط التي تحدد موضع التوازن، فإن اتجاهاً ما سيقوى في النظام، مما يؤدي إلى إضعاف التأثير الخارجي، وسوف يتحول موضع التوازن في النظام نفس الاتجاه." في أغلب الأحيان، تكون الظروف التي تحدد موضع التوازن هي درجة الحرارة والضغط والتركيز.
دعونا نوضح الأهمية التنبؤية للمعادلات المشتقة كخاصية كمية لمبدأ تحول التوازن باستخدام مثال تخليق الأمونيا: N 2 + 3H 2 ↔ 2NH 3 - ∆H

دعونا نكتب معادلة الأيزوبار
لنفترض أن هذا النظام تم تسخينه ΔH<0. Правая часть уравнения изотермы уменьшится (∆Н/RT 2)<0, значит левая часть тоже уменьшится: (d ln к р /d P)<0 (она может уменьшиться за счет уменьшения к р).

ثابت التوازن لتخليق الأمونيا له الشكل She
يمكن أن ينخفض بسبب انخفاض ضغط منتجات التفاعل وزيادة ضغط المواد الأولية. وهذا يعني أنه عند تسخينه، يتحول هذا التفاعل الطارد للحرارة نحو العملية الماصة للحرارة لتحلل الأمونيا. تم الحصول على هذه النتيجة بناءً على تحليل إيزوبار Van't Hoff. ومن السهل إظهار أنها تتفق مع التنبؤ بمبدأ لو شاتيليه. ويمكن الحصول على نتيجة مماثلة من خلال تطبيق معادلات بلانك لتحليل هذا التفاعل، مع الأخذ في الاعتبار أن الضغط P هو معكوس الحجم 1/V. ويطلب من الطلاب القيام بهذه الإجراءات بشكل مستقل.
يمكن وصف اعتماد ثابت توازن التفاعل على درجة الحرارة من خلال معادلة إيزوبار التفاعل الكيميائي (فانت هوف إيزوبار):
و isochores من التفاعل الكيميائي (isochores فانت هوف):
![]()
هنا Δ حو Δ ش- التأثير الحراري للتفاعل الذي يحدث، على التوالي، عند ضغط ثابت أو حجم ثابت. إذا Δ ح> 0 (التأثير الحراري إيجابي، والتفاعل ماص للحرارة)، ثم يكون معامل درجة الحرارة ثابتًا
التوازن إيجابي أيضًا، أي أنه مع زيادة درجة الحرارة، يزداد ثابت توازن التفاعل الماص للحرارة، وينزاح التوازن إلى اليمين (وهو ما يتوافق تمامًا مع مبدأ لو شاتيليه).
ثابت التوازن وثابت معدل التفاعل
بالنسبة للتفاعل الكيميائي العكسي، يمكن التعبير عن ثابت التوازن بدلالة ثوابت معدل التفاعلات الأمامية والعكسية، استنادا إلى حقيقة أنه في حالة التوازن تكون معدلات التفاعلات الأمامية والعكسية متساوية. على سبيل المثال، لتفاعل كيميائي عكسي أولي من الدرجة الأولى
من السهل إظهار ما يلي:
أين ك 1 هو معدل ثابت للتفاعل الأمامي، و ك 2 - يعكس. توفر هذه العلاقة المهمة إحدى "نقاط الاتصال" بين الحركية الكيميائية والديناميكا الحرارية الكيميائية.
طرق حساب ثابت التوازن
عادةً ما تتلخص طرق الحساب لتحديد ثابت التوازن للتفاعل في حساب التغير المعياري في طاقة جيبس أثناء التفاعل بطريقة أو بأخرى ( ΔG 0 )، ثم استخدم الصيغة:
يجب أن نتذكر أن طاقة جيبس هي دالة لحالة النظام، أي أنها لا تعتمد على مسار العملية، على آلية التفاعل، ولكن يتم تحديدها فقط من خلال الحالات الأولية والنهائية للنظام . لذلك، إذا كان التحديد المباشر أو الحساب ΔG 0 لبعض ردود الفعل صعبة لسبب ما، يمكنك تحديد ردود الفعل المتوسطة التي ΔG 0 معروفة أو يمكن تحديدها بسهولة، ومجموعها سيعطي رد الفعل المعني (انظر قانون هيس). على وجه الخصوص، غالبًا ما تستخدم تفاعلات تكوين المركبات من العناصر كتفاعلات وسيطة.
حساب الإنتروبيا للتغير في طاقة جيبس وثابت التوازن للتفاعل
طريقة حساب الانتروبيا ΔGرد الفعل هو واحد من الأكثر شيوعا وملاءمة. يعتمد على العلاقة:
أو، وفقا لذلك، ل معيارتغيرات طاقة جيبس:
هنا ΔH 0 عند ضغط ودرجة حرارة ثابتين يساوي التأثير الحراري للتفاعل، وطرق الحساب وتحديده التجريبي معروفة - انظر، على سبيل المثال، معادلة كيرشوف:
![]()
من الضروري الحصول على التغير في الإنتروبيا أثناء التفاعل. ويمكن حل هذه المشكلة بعدة طرق، على سبيل المثال:
وفقًا للبيانات الحرارية - بناءً على نظرية نيرنست الحرارية واستخدام معلومات حول اعتماد درجة الحرارة على السعة الحرارية للمشاركين في التفاعل. على سبيل المثال، بالنسبة للمواد التي تكون في الحالة الصلبة في الظروف العادية:
![]()
حيث S 0 = 0 (مسلمة بلانك)، وبالتالي،
![]() .
.
(هنا فهرس sol مأخوذ من المادة الصلبة الإنجليزية). عند درجة حرارة معينة T:
![]()
بالنسبة للمواد السائلة أو الغازية عند درجة الحرارة العادية، أو بشكل عام، للمواد التي تمر بمرحلة انتقالية في نطاق درجة الحرارة من 0 (أو 298) إلى T، يجب أن يؤخذ في الاعتبار التغير في الإنتروبيا المرتبط بهذا التحول المرحلي .
للغازات المثالية - بطرق إحصائيات الكم.
وباستخدام أساليب تجريبية وشبه تجريبية مختلفة، غالبًا ما تكون كمية صغيرة من البيانات الأولية كافية لهذا الغرض. على سبيل المثال، بالنسبة للمواد الصلبة غير العضوية، يمكن تقدير الإنتروبيا باستخدام الصيغة
حيث A وB ثوابت جدولية اعتمادًا على نوع المركب المعني، M هو الوزن الجزيئي.
لذا، إذا كانت السعة الحرارية تعتمد على درجة الحرارة، فيمكن حسابها باستخدام الصيغة:
يتم الحصول على نسخة مبسطة إلى حد ما من هذه الصيغة من خلال النظر في مجموع السعات الحرارية للمواد لتكون مستقلة عن درجة الحرارة وتساوي مجموع السعات الحرارية عند 298 كلفن:
ويتم إجراء حساب أكثر بساطة من خلال مساواة مجموع السعات الحرارية بالصفر:
يتم الانتقال من إلى ثابت التوازن وفقًا للصيغة المذكورة أعلاه.
مبدأ لو شاتيلير-براون(1884) - إذا تأثر النظام الموجود في حالة توازن مستقر من الخارج، مما أدى إلى تغيير أي من ظروف التوازن (درجة الحرارة والضغط والتركيز)، فإن العمليات في النظام التي تهدف إلى تعويض التأثير الخارجي تتكثف.
صاغ هنري لو شاتيليه (فرنسا) هذا المبدأ الديناميكي الحراري للتوازن المتحرك، والذي عممه لاحقًا كارل براون
دعونا نفكر في رد الفعل العكسي العام
تظهر الدراسات التجريبية أنه في حالة التوازن تكون العلاقة التالية:

(الأقواس المربعة تشير إلى التركيز). العلاقة المذكورة أعلاه هي تعبير رياضي لقانون فعل الكتلة، أو قانون التوازن الكيميائي، والذي بموجبه، في حالة التوازن الكيميائي عند درجة حرارة معينة، يكون حاصل ضرب تراكيز نواتج التفاعل في القوى والأسس
التي تساوي المعاملات المقابلة في معادلة التفاعل المتكافئة، مقسومة على ناتج مماثل لتركيزات المواد المتفاعلة في القوى المقابلة، تمثل قيمة ثابتة. ويسمى هذا الثابت ثابت التوازن. يعد التعبير عن ثابت التوازن من حيث تركيزات المنتجات والكواشف أمرًا نموذجيًا للتفاعلات في المحاليل.
لاحظ أن الجانب الأيمن من تعبير ثابت التوازن يحتوي فقط على تركيزات المواد المذابة. ويجب ألا يتضمن أي مصطلحات تتعلق بالمواد الصلبة النقية، أو السوائل النقية، أو المذيبات المشاركة في التفاعل، حيث أن هذه المصطلحات ثابتة.
بالنسبة للتفاعلات التي تتضمن غازات، يتم التعبير عن ثابت التوازن بدلالة الضغوط الجزئية للغازات، وليس بدلالة تركيزاتها. في هذه الحالة، يتم الإشارة إلى ثابت التوازن بالرمز.
يمكن التعبير عن تركيز الغاز بدلالة ضغطه باستخدام معادلة الحالة المثالية للغاز (انظر القسم 3.1):
ويترتب على هذه المعادلة
أين هو تركيز الغاز، والذي يمكن الإشارة إليه بـ [الغاز]. وبما أن - قيمة ثابتة، يمكننا أن نكتب ذلك عند درجة حرارة معينة
دعونا نعبر عن ثابت التوازن للتفاعل بين الهيدروجين واليود بدلالة الضغوط الجزئية لهذه الغازات.
معادلة هذا التفاعل لها الشكل
ولذلك، يتم إعطاء ثابت التوازن لهذا التفاعل بواسطة
![]()
دعونا نلاحظ أن التركيزات أو الضغوط الجزئية للمنتجات، أي المواد المشار إليها على الجانب الأيمن من المعادلة الكيميائية، تشكل دائمًا البسط، والتركيزات أو الضغوط الجزئية للمواد المتفاعلة، أي المواد المشار إليها على الجانب الأيسر من المادة الكيميائية المعادلة، تكون دائمًا مقام التعبير الخاص بثابت التوازن.
وحدات قياس ثابت التوازن
يمكن أن يكون ثابت التوازن كمية بعدية أو بلا أبعاد، اعتمادًا على نوع تعبيرها الرياضي. في المثال أعلاه، ثابت التوازن هو كمية بلا أبعاد لأن بسط ومقام الكسر لهما نفس الأبعاد. وبخلاف ذلك، فإن ثابت التوازن له بُعد معبر عنه بوحدات التركيز أو الضغط.
ما بُعد ثابت التوازن للتفاعل التالي؟
ولذلك فإن لها البعد (mol-dm-3)

لذلك، فإن البعد ثابت التوازن قيد النظر هو أو dm3/mol.
ما بُعد ثابت التوازن للتفاعل التالي؟

يتم تحديد ثابت التوازن لهذا التفاعل من خلال التعبير
ولذلك، فإن لها أبعادا
![]()

إذن، بُعد ثابت التوازن هذا هو: atm أو Pa.
التوازنات غير المتجانسة
لقد قدمنا حتى الآن أمثلة فقط على التوازنات المتجانسة. على سبيل المثال، في تفاعل تخليق يوديد الهيدروجين، يكون كل من المنتج والمواد المتفاعلة في حالة غازية.
كمثال على التفاعل الذي يؤدي إلى توازن غير متجانس، فكر في التفكك الحراري لكربونات الكالسيوم
يتم إعطاء ثابت التوازن لهذا التفاعل بواسطة
![]()
لاحظ أن هذا التعبير لا يتضمن أي مصطلحات تتعلق بالمواد الصلبة المشاركة في التفاعل. في المثال الموضح، يمثل ثابت التوازن ضغط تفكك كربونات الكالسيوم. ويبين أنه إذا تم تسخين كربونات الكالسيوم في وعاء مغلق، فإن ضغط تفككها عند درجة حرارة ثابتة لا يعتمد على كمية كربونات الكالسيوم. وفي القسم التالي، سوف نتعلم كيف يتغير ثابت التوازن مع درجة الحرارة. في المثال قيد النظر، يتجاوز ضغط التفكك 1 ضغط جوي فقط عند درجة حرارة أعلى، وذلك من أجل ثاني أكسيد
حسنًا، لقد بدأنا في الوصول إلى هذه النقطة. يجب أن تفهم بالفعل ما هو المتغير وكيفية استخدام الشروط في برامجك. آمل أن يكون الأمر كذلك، وإلا فإن كل شيء آخر لا معنى له بالنسبة لك لقراءته.
عندما تحدثت عن المتغيرات، تركت نوعًا آخر من المتغيرات. هذا المتغير، على عكس المتغير الآخر، يخزن قيمته طوال تنفيذ البرنامج. يتم بدء تشغيله عند الإعلان ولا يمكن تغييره في كود آخر. يسمى هذا المتغير ثابت.
ما هي الثوابت ل؟ لتخزين المعلومات الدائمة. وبقدر ما لا أرغب في إجراء مقارنات رياضية، إلا أنها الأكثر وضوحًا. تذكر الفيزياء - ثابت الجاذبية، ودرجة الحرارة بالكلفن، والفهرنهايت، وما إلى ذلك. كل هذه ثوابت. في الواقع، لقد أعلنا ذات مرة عن مثل هذا المتغير ونسينا معناه، واستبدلنا اسمه في البرنامج. قد تتساءل، لماذا لا يمكنك استخدام متغير بسيط لتخزين مثل هذه المعلومات؟ ولكن لأنه يمكنك تعيين قيمة مختلفة لهذا المتغير، ولكن ليس للثابت.
دعونا نلقي نظرة على بناء الجملة، وبعد ذلك سأقدم مثالا مرئيا.
في لغة C، تم تعريف الثابت بواسطة التوجيه # يُعرِّف
#define PI 3.14 // سيحتوي PI الآن على 3.14
يمكن العثور على هذا التوجيه في العديد من البرامج الحالية، لكنه نهج قديم. تم تقديم معدّل جديد في لغة C++ مقدار ثابت.
Const float PI=3.14;\
Const float PI=3.14; int _tmain(int argc, _TCHAR* argv) ( setlocale (0,""); // تعيين اللغة الافتراضية (الروسية) int S,R=21; // مساحة الدائرة ونصف قطرها S=PI*R*R النظام ("إيقاف مؤقت")؛ // لمنع إغلاق النافذة return 0;
أينما نسمي هذا المتغير، فإنه في كل مكان سيكون يساوي 3.14. مريحة للغاية، أليس كذلك؟ بالمناسبة، من أجل التجربة، حاول تعيين بعض القيمة لـ PI في البرنامج. انظر كيف يتفاعل المترجم.
حسنًا، في الختام، فيما يتعلق بالثوابت، يمكنني القول أنه يمكنك استخدام التعبير الحسابي كثابت.
كونست برويز = 23*12; // الآن لدينا الرقم 276 في الثابت
تذكر أيضًا قاعدة واحدة - يجب دائمًا كتابة الأسماء الثابتة بأحرف كبيرة!وهذا سيجعل حياتك أسهل أيضًا، لأنه عندما تواجه ثابتًا منسقًا بشكل صحيح، ستفهم على الفور أنه ثابت.
جنبا إلى جنب مع الثوابت، يتم استخدامها على نطاق واسع في البرمجة التحويلات. وهي في جوهرها مجموعة من الثوابت. إنها ضرورية للحد من نطاق قيم المتغير. يمكن أن يكون هذا اليوم من الأسبوع أو الشهر أو الجنس (الزوج أو الزوجة)، وما إلى ذلك. تُستخدم التعدادات على نطاق واسع بشكل خاص في كتابة الألعاب.
حسنًا، دعونا الآن ننسى ما كتبته أعلاه وننظر إلى التعداد كمثال.
يجب الإعلان عن التعدادات خارج الوظيفة الرئيسية. النقطة المهمة هي أنه نوع محدد من قبل المبرمج. وينبغي الإعلان عن هذه الأنواع، إلى جانب الهياكل والفئات، ويفضل أن يكون ذلك في وحدة منفصلة. لكننا سننظر في كل هذا لاحقًا. وإليك كيفية إعلان التعداد:
شهر التعداد (يناير، فبراير، مارس، أبريل، مايو، يونيو، يوليو، أغسطس، سبتمبر، أكتوبر، نوفمبر، ديسمبر)؛
يبدأ التعداد بالكلمة المفتاحية enum ثم اسم التعداد ( هذا ليس متغير!!!)، ويتم الإشارة إلى مجموعة القيم بين قوسين.
الآن يمكننا استخدام النوع المعلن في برنامجنا:
Int main () (الشهر curMonth=June؛ // الآن // يتم تخزين يوليو في متغير curMonth)
ما رأيك يتم تخزينه في متغير curMonth؟ إذا كنت تعتقد أنه شهر يونيو، فأنت مخطئ. التعداد هو نوع رقمي ويتم تحويله ضمنيًا إلى int. يبدأ الترقيم من 0. بمعرفة ذلك، يمكننا أن نفترض أن curMonth يحتوي على الرقم 5. بمعنى آخر، يمكننا تخصيص هذا المتغير، بدلاً من اسم الشهر، إلى نظيره الرقمي في تفسير التعداد وسنكون على حق.
وبطبيعة الحال، المثال مع شهر أو يوم من الأسبوع ليس واضحا جدا. ومع ذلك، يجب أن تفهم أن المتغير يمكن أن يقتصر على نطاق من القيم. جربه، وقم بتعيين قيمة curMonth بخلاف التعداد وانظر ماذا يسميك المترجم J.
لكن في البرمجة، على سبيل المثال في نظام Windows، سنواجه غالبًا التعدادات والثوابت. هذا هو المكان الذي ستفهم فيه تمامًا راحة استخدامها.
الآن دعونا نعود إلى مثالنا ونرى ما الذي يمكننا تغييره. ونرقم الأشهر من الواحد وليس من الصفر. من الكود الخاص بنا، يمكنك أن ترى أن 100 يونيو قد تم تعيينه بالقيمة 5، وليس 6. حسنًا، يمكنك تعيين الترقيم الخاص بك في التعداد.
لقد قمت بتعيين القيمة 1 بشكل صريح لـ Jan. وسيقوم المترجم نفسه بتعيين القيم الضرورية للأشهر المتبقية. بالطبع، يمكنك القيام بكل شيء يدويًا، لكن لا فائدة من القيام بذلك.
وأخيرا. يمكن أيضًا الإعلان عن متغير عند تحديد التعداد:
شهر التعداد (يناير = 1، فبراير، مارس، أبريل، مايو، يونيو، يوليو، أغسطس، سبتمبر، أكتوبر، نوفمبر، ديسمبر) هذا الشهر؛
ثم يمكن بالفعل استخدام هذا المتغير في البرنامج. يمكنك الإعلان عن الكثير منهم هناك. لكن شخصياً لا أحب هذه الطريقة، لأنها مربكة بعض الشيء. في النهاية، نحن لا نبرمج بلغة C، بل بلغة C++.
يقذف
اقرأ هنا بعناية. الحقيقة هي أن لغة C++ مشهورة بأخطاءها الحسابية في العمليات الحسابية. لا، فهو يحسب كل شيء بشكل صحيح، ولكن نتيجة الحساب تعتمد بشكل كبير على نوع المتغير. المبرمج الذي يقرر تعيين حاصل القسمة لكتابة int قد لا يحصل في كثير من الأحيان على النتيجة المرجوة. الحقيقة هي أن مترجم اللغة يقوم بإجراء تحويلات ضمنية للنوع.
هنا مثال. نحن بحاجة لحساب راتب الموظف. نحن نعرف معدل الساعة. ثم نضرب هذه القيمة بعدد ساعات العمل ونحصل على النتيجة المرجوة. كل شيء بسيط هنا. لكن تخيل مديرًا يعين موظفًا ولا يعرف المبلغ الذي سيدفعه له. ثم يأخذ راتب المنطقة ويقسمه على عدد الساعات.
إنت زارب، ساعة، فيل؛ فيل=22320; // الراتب في المدينة هو 22320 روبل في الساعة=22 * 8؛ // عدد الساعات 22 يوم عمل * يوم عمل 8 ساعات zarp=vel /hour; // ساعتنا cout<<"Час работника стоит =" < سيعطينا البرنامج رقم 126 روبل. هذا يناسبنا، ولكن من السهل أن نأخذ آلة حاسبة ونحسب أن الرقم في الواقع هو 126.8، وإذا لم يشعر الموظف بالإهانة من هذا العيب، فإن مثل هذه الأخطاء غير مقبولة في الحسابات. ماذا حدث؟ zarp هو عدد صحيح ويقوم فقط بتخزين قيمة العدد الصحيح. سيتم التخلص من الجزء الكسري. بمعنى آخر، كان من الضروري استخدام النوع المزدوج الذي يقوم بتخزين الكسر. ولكن هنا الوضع أكثر إثارة للاهتمام إلى حد ما. يقوم المترجم مؤقتًا بتعيين النوع المزدوج لمتغيري الساعة والفيل، كما لو كان يوسع معناهما. قد لا ندرك ذلك، على الرغم من أهمية فهمه. المترجم، الذي يواجه نوعًا أكبر، يعين معامله للنوع الأصغر. هذه هي القاعدة. ومع ذلك، تخيل موقفًا حيث يهدر مبرمج مصاب بجنون العظمة الذاكرة عبثًا (هل تتذكر أن النوع المزدوج أكبر مرتين من int؟) ويحاول تعيين هذا النوع بالضبط في كل مكان. نعم، إنها تحصل على القيمة الدقيقة، مع التضحية ببعض الأداء (العمليات ذات الأنواع الكسرية أبطأ من الأنواع الصحيحة، لكن هذا لم يعد ذا صلة)، لكنك تضع نفسك في الزاوية بشكل مصطنع. دعنا نعود إلى مديرنا، الذي لا يزال لا يعرف المبلغ الذي يجب أن يدفعه مقابل عمله. لنفترض أن المحاسب الدقيق أعطاه قيمة بالساعة تبلغ 132.12 روبل. ستقوم على الفور بتعيين القيمة المزدوجة له، وتبدأ في الحساب، وتعوي عندما تظهر البنسات في كل مكان. حسنًا، لا نحتاج إلى إعطائها للموظف! في هذه الحالة، إذا ارتكبت مثل هذا الخطأ، فيمكنك إجراء تمثيل واضح. في C تم ذلك على النحو التالي: (نوع الزهر) التعبير
(دولي)فيل؛ // تحويل النوع بشكل مصطنع إلى عدد صحيح. في C++، قدم Strupstrup تحولًا جديدًا. وهنا وصفه: ثابتة
_
يقذف
<тип>(تعبير)
تعتبر التحولات علامة على الذوق البرمجي السيئ. إذا كان لديك عدد كبير جدًا من التحويلات، فمن المرجح أنك تحتاج إلى تغيير جميع القيم في البرنامج. ومع ذلك، غالبا ما تستخدم التحولات في OOP. لن نتطرق إليها الآن على أي حال، مع الممارسة سوف تفهم كل شيء على الفور. لذا اذهب للحصول على بعض الراحة. سيكون الدرس التالي أكثر صعوبة وأهم بكثير. أسارع إلى إرضائك - هناك بعض الدروس المتبقية من هذا الأساس وسنبدأ البرمجة العادية.