Ekuilibri kimik është gjendja e një reaksioni kimik të kthyeshëm
aA + b B= c C+ d D,
në të cilën me kalimin e kohës nuk ka ndryshim të përqendrimeve të reaktantëve në përzierjen e reaksionit. Karakterizohet gjendja e ekuilibrit kimik konstante e ekuilibrit kimik:
Ku C i janë përqendrimet e komponentëve në ekuilibri përzierje perfekte.
Konstanta e ekuilibrit mund të shprehet edhe në terma të fraksioneve mole të ekuilibrit X i komponentët:
Për reaksionet që ndodhin në fazën e gazit, është e përshtatshme të shprehet konstanta e ekuilibrit në termat e presioneve të pjesshme të ekuilibrit Pi komponentët:
Për gazet ideale Pi = C i RT Dhe Pi = X i P, Ku Pështë presioni total, pra K P, K C Dhe K X lidhen me relacionin e mëposhtëm:
K P = K C (RT) c+d–a–b = K X P c+d–a–b. (9.4)
Konstanta e ekuilibrit lidhet me r G o reaksion kimik:
![]() (9.5)
(9.5)
![]() (9.6)
(9.6)
Ndryshimi r G ose r F në një reaksion kimik në presione të pjesshme të dhëna (jo domosdoshmërisht ekuilibër). Pi ose përqendrimet C i komponentët mund të llogariten me ekuacion izotermave të reaksioneve kimike (izotermat van't Hoff):
 . (9.7)
. (9.7)
 . (9.8)
. (9.8)
Sipas parimi i Le Chatelier Nëse një ndikim i jashtëm ushtrohet në një sistem në ekuilibër, atëherë ekuilibri do të zhvendoset në atë mënyrë që të zvogëlojë efektin e ndikimit të jashtëm. Kështu, një rritje në presion e zhvendos ekuilibrin në drejtim të një rënie të numrit të molekulave të gazit. Shtimi i një komponenti reaksioni në një përzierje ekuilibri e zhvendos ekuilibrin në drejtim të zvogëlimit të sasisë së këtij përbërësi. Një rritje (ose ulje) e temperaturës e zhvendos ekuilibrin në drejtim të një reaksioni që vazhdon me thithjen (lëshimin) e nxehtësisë.
Në mënyrë sasiore, varësia e konstantës së ekuilibrit nga temperatura përshkruhet nga ekuacioni izobaret e një reaksioni kimik (van't Hoff isobars)
![]() (9.9)
(9.9)
Dhe izokoret e një reaksioni kimik (van't Hoff isochores)
![]() . (9.10)
. (9.10)
Integrimi i ekuacionit (9.9) nën supozimin se rH Reaksioni nuk varet nga temperatura (që është e vërtetë në intervale të ngushta të temperaturës), jep:
![]() (9.11)
(9.11)
![]() (9.12)
(9.12)
Ku C- konstante integrimi. Kështu, varësia ln K P nga 1 /T duhet të jetë lineare, dhe pjerrësia e vijës së drejtë është - rH/R.
Integrimi brenda K 1 , K 2, dhe T 1, T 2 jep:
 (9.13)
(9.13)
 (9.14)
(9.14)
Duke përdorur këtë ekuacion, duke ditur konstantet e ekuilibrit në dy temperatura të ndryshme, mund të llogarisim rH reagimet. Prandaj, duke ditur rH reaksioni dhe konstantja e ekuilibrit në një temperaturë, mund të llogarisni konstantën e ekuilibrit në një temperaturë tjetër.
SHEMBUJ
CO (g) + 2H 2 (g) \u003d CH3 OH (g)
në 500 mijë. f G o për CO(g) dhe CH 3 OH(g) në 500 K janë –155,41 kJ. mol –1 dhe –134,20 kJ. mol –1, përkatësisht.
Zgjidhje. Shkoni reagimet:
r G o= f G o(CH 3 OH) - f G o(CO) = –134,20 – (–155,41) = 21,21 kJ. mol -1.
![]() = 6.09 10 –3 .
= 6.09 10 –3 .
Shembulli 9-2. Konstanta e ekuilibrit të reaksionit
është e barabartë me K P = 1,64 10 –4 në 400 o C. Çfarë presioni total duhet të ushtrohet në një përzierje ekuimolare të N 2 dhe H 2 për të kthyer 10% N 2 në NH 3 ? Supozohet se gazet janë ideale.
Zgjidhje. Le të reagojë mol N 2. Pastaj
| N 2 (g) | + | 3H 2 (g) | = | 2NH 3 (g) | |
| Sasia fillestare | 1 | 1 | |||
| Sasia e ekuilibrit | 1– | 1–3 | 2 (Totali: 2–2) | ||
| Fraksioni molik i ekuilibrit: |
Prandaj, K X=  Dhe K P = K X . P –2
=
Dhe K P = K X . P –2
=  .
.
Duke zëvendësuar = 0.1 në formulën që rezulton, ne kemi
1.64 10 –4 = , ku P= 51,2 atm.
, ku P= 51,2 atm.
Shembulli 9-3. Konstanta e ekuilibrit të reaksionit
CO (g) + 2H 2 (g) \u003d CH3 OH (g)
në 500 K është K P = 6.0910-3. Përzierja e reaksionit e përbërë nga 1 mol CO, 2 mol H 2 dhe 1 mol gaz inert (N 2) nxehet në 500 K dhe një presion total prej 100 atm. Llogaritni përbërjen e përzierjes së ekuilibrit.
Zgjidhje. Le të reagojë një mol CO. Pastaj
| CO(g) | + | 2H 2 (g) | = | CH 3 OH (g) | |
| Shuma fillestare: | 1 | 2 | 0 | ||
| Sasia e ekuilibrit: | 1– | 2–2 | |||
| Totali në përzierjen e ekuilibrit: | 3-2 mol përbërës + 1 mol N 2 \u003d 4-2 mol | ||||
| Fraksioni molik i ekuilibrit | |||||
Prandaj, K X=  Dhe K P = K X . P-2 =
Dhe K P = K X . P-2 = ![]() .
.
Kështu, 6,09 10 –3 = ![]() .
.
Duke zgjidhur këtë ekuacion, marrim = 0,732. Prandaj, fraksionet molare të substancave në përzierjen e ekuilibrit janë: = 0,288, = 0,106, = 0,212 dhe = 0,394.
Shembulli 9-4. Për reagim
N 2 (g) + 3H 2 (g) \u003d 2NH 3 (g)
në 298 K K P = 6.0 10 5, dhe f H o(NH 3) \u003d -46,1 kJ. mol -1. Vlerësoni vlerën e konstantës së ekuilibrit në 500 K.
Zgjidhje. Entalpia standarde molare e reaksionit është
r H o= 2f H o(NH 3) \u003d -92,2 kJ. mol -1.
Sipas ekuacionit (9.14), 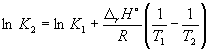 =
=
Ln (6.0 10 5) + ![]() = –1,73, prej nga K 2 =
0.18.
= –1,73, prej nga K 2 =
0.18.
Vini re se konstanta e ekuilibrit të një reaksioni ekzotermik zvogëlohet me rritjen e temperaturës, që korrespondon me parimin e Le Chatelier.
DETYRAT
- Në 1273 K dhe një presion total prej 30 atm në një përzierje ekuilibri
- Në 2000 o C dhe një presion total prej 1 atm, 2% e ujit shpërndahet në hidrogjen dhe oksigjen. Llogaritni konstantën e ekuilibrit të reaksionit
- Konstanta e ekuilibrit të reaksionit
- Konstanta e ekuilibrit të reaksionit
- Një enë 3-L që përmbante 1,7910-2 mol I 2 u ngroh në 973 K. Presioni në enë në ekuilibër doli të ishte 0,49 atm. Duke supozuar gazrat idealë, llogaritni konstantën e ekuilibrit në 973 K për reaksionin
- Për reagim
- Për reagim
- Një enë 1 litërshe që përmbante 0,341 mol PCl 5 dhe 0,233 mol N 2 u ngroh në 250 o C. Presioni total në enë në ekuilibër ishte 29,33 atm. Duke i konsideruar të gjithë gazrat si idealë, llogaritni konstantën e ekuilibrit në 250 o C për reaksionin që zhvillohet në enë.
- Konstanta e ekuilibrit të reaksionit
- Në 25°C f G o(NH 3) = –16,5 kJ. mol -1. Llogaritni r G reaksionet e formimit të NH 3 në presione të pjesshme të N 2 , H 2 dhe NH 3 të barabarta me përkatësisht 3 atm, 1 atm dhe 4 atm. Në cilin drejtim do të vazhdojë reaksioni spontanisht në këto kushte?
- reaksion ekzotermik
- Konstanta e ekuilibrit të reaksionit të izomerizimit në fazën e gazit të borneolit (C10H17OH) ndaj izoborneolit është 0.106 në 503 K. Një përzierje prej 7.5 g borneol dhe 14.0 g izoborneol u vendos në një enë 5-L dhe u mbajt në 503 K deri në equili. u arrit. Llogaritni fraksionet molore dhe masat e borneolit dhe izoborneolit në një përzierje ekuilibri.
- Ekuilibri në reaksion
- Llogaritni presionin total që duhet të aplikohet në një përzierje prej 3 pjesësh H 2 dhe 1 pjesës N 2 për të përftuar një përzierje ekuilibri që përmban 10% NH 3 në vëllim në 400 o C. Konstanta e ekuilibrit për reaksionin
- Në 250 o C dhe një presion total prej 1 atm, PCl 5 disociohet me 80% sipas reaksionit
- Në 2000 o C për reaksionin
- Njehsoni entalpinë standarde të reaksionit për të cilin është konstanta e ekuilibrit
a) rritet me 2 herë, b) zvogëlohet me 2 herë kur temperatura ndryshon nga 298 K në 308 K. - Varësia e konstantës së ekuilibrit të reaksionit 2C 3 H 6 (g) \u003d C 2 H 4 (g) + C 4 H 8 (g) nga temperatura midis 300 K dhe 600 K përshkruhet nga ekuacioni
CO 2 (g) + C (tv) \u003d 2 CO (g)
përmban 17% (në vëllim) CO 2 . Sa përqind e CO 2 do të përmbahet në gaz në një presion total prej 20 atm? Në çfarë presioni gazi do të përmbajë 25% CO 2 ?
H 2 O (g) \u003d H 2 (g) + 1 / 2O 2 (g) në këto kushte.
CO (g) + H 2 O (g) \u003d CO 2 (g) + H 2 (g)
në 500 o C është Kp= 5.5. Një përzierje prej 1 mol CO dhe 5 mol H 2 O u ngroh në këtë temperaturë. Njehsoni fraksionin mol të H 2 O në përzierjen e ekuilibrit.
N 2 O 4 (g) \u003d 2NO 2 (g)
në 25 o C është Kp= 0,143. Llogaritni presionin që do të vendoset në një enë 1 litri në të cilën vendoset 1 g N 2 O 4 në këtë temperaturë.
I 2 (g) = 2I (g).
në 250°C r G o \u003d -2508 J. mol -1. Në çfarë presioni total do të jetë 30% shkalla e shndërrimit të PCl 5 në PCl 3 dhe Cl 2 në 250 o C?
2HI (g) \u003d H 2 (g) + I 2 (g)
konstante ekuilibri K P = 1,83 10 –2 në 698,6 K. Sa gram HI formohen kur 10 g I 2 dhe 0,2 g H 2 nxehen në këtë temperaturë në një enë me tre litra? Cilat janë presionet e pjesshme të H 2 , I 2 dhe HI?
PCl 5 (g) = PCl 3 (g) + Cl 2 (g)
CO (g) + 2H 2 (g) \u003d CH3 OH (g)
në 500 K është K P = 6.0910-3. Llogaritni presionin total të nevojshëm për të prodhuar metanol me rendiment 90% nëse CO dhe H 2 merren në një raport 1:2.
CO (g) + 2H 2 (g) \u003d CH3 OH (g)
është në ekuilibër në 500 K dhe 10 bar. Nëse gazrat janë idealë, si do të ndikojnë faktorët e mëposhtëm në rendimentin e metanolit: a) në rritje T; b) promovimi P; c) shtimi i një gazi inert në V= konst; d) shtimi i një gazi inert në P= konst; e) duke shtuar H 2 në P= konst?
2NOCl (g) \u003d 2NO (g) + Cl 2 (g)
vendosur në 227 o C dhe presion total 1.0 bar, kur presioni i pjesshëm i NOCl është i barabartë me 0.64 bar (fillimisht ishte i pranishëm vetëm NOCl). Llogaritni r G o për një reagim. Në çfarë presioni total presioni i pjesshëm i Cl 2 do të jetë 0,10 bar?
N 2 (g) + 3H 2 (g) \u003d 2NH 3 (g)
në 400 o C është K = 1.60 10 –4 .
PCl 5 (g) = PCl 3 (g) + Cl 2 (g).
Sa do të jetë shkalla e shpërbërjes së PCl 5 nëse sistemit i shtohet N 2 në mënyrë që presioni i pjesshëm i azotit të jetë 0,9 atm? Presioni total mbahet në 1 atm.
N 2 (g) + O 2 (g) \u003d 2NO (g)
Kp = 2.510-3. Një përzierje ekuilibri e N 2 , O 2 , NO dhe një gazi inert në një presion total prej 1 bar përmban 80% (në vëllim) N 2 dhe 16 % O 2 . Sa përqind në vëllim është JO? Sa është presioni i pjesshëm i një gazi inert?
ln K = –1.04 –1088 /T +1.51 10 5 /T 2 .
Ekuacionet e izobarit, izokoret, reaksionet e van't Hofit dhe ekuacioni i Plankut
Pothuajse gjithmonë bëhet e nevojshme kalimi nga një gjendje reagimi në një tjetër. Për ta bërë këtë, ju duhet të dini varësinë e konstanteve të ekuilibrit nga temperatura dhe presioni. Njohja e konstantave të ekuilibrit në temperatura dhe presione të ndryshme zgjeron aftësitë e inxhinierit kimik në parashikimin e rezultateve të procesit.
Varësia e konstantës së ekuilibrit nga temperatura merret duke diferencuar izotermën e reaksionit në lidhje me temperaturën, me kusht që presionet në k p të jenë të pavarura nga temperatura.
Ne marrim shprehjen

duke pjesëtuar të gjithë termat e këtij ekuacioni me T, shprehim termin në terma d∆G/dT. Ne e zëvendësojmë atë në shprehjen e diferencuar të izotermës

Ekuacioni që rezulton quhet izobar i reaksionit van't Hoff. Një qasje krejtësisht identike përdoret për të nxjerrë izokoren e një reaksioni, i cili përdor ndryshimin e energjisë së Helmholtz-it dhe përbërja e sistemit shprehet në terma të përqendrimeve. Shprehja izokore ka formën

ku ∆Н dhe ∆U janë efekte termodinamike.
Për të marrë varësinë e konstantës së ekuilibrit nga presioni, përdoret një qasje paksa e ndryshme. k P dhe k c nuk varen nga presioni. Nga lidhja e konstanteve të ekuilibrit të shprehura në mënyra të ndryshme (6), shihet se konstanta k n varet nga presioni: k n = k Р ∙ Р -∆ n.
Marrim logaritmin e kësaj shprehjeje dhe më pas e diferencojmë në lidhje me P:
Vini re se d ln k p /d P = 0 sipas supozimit; d ln P/d P = 1/P prej nga marrim d ln në N /d P = - ∆n/P; Δn gjendet nga ekuacioni Clapeyron-Mendeleev, duke e shkruar atë për dy gjendje si PΔV = ΔnRT. Le të shprehim ΔV nga këtu dhe ta zëvendësojmë atë në shprehjen e diferencuar për konstantën e ekuilibrit
k n, marrim ekuacionin e Planck-ut që shpreh varësinë e konstantës së ekuilibrit nga presioni
Ekuacionet izokore, izobaret e reaksionit dhe ekuacioni i Plankut kanë vlerë parashikuese dhe janë me interes të konsiderueshëm për teknologët. Këto ekuacione janë një karakteristikë sasiore e parimit të zhvendosjes së ekuilibrit të Le Chatelier. Ky parim mund të formulohet si më poshtë: “Nëse një sistem në ekuilibër veprohet nga jashtë, duke ndryshuar ndonjë nga kushtet që përcaktojnë pozicionin e ekuilibrit, atëherë një drejtim i tillë do të rritet në sistem, rezultati i të cilit do të dobësojë ndikimin e jashtëm dhe pozicioni i ekuilibrit do të zhvendoset. në të njëjtin drejtim.” Më shpesh, kushtet që përcaktojnë pozicionin e ekuilibrit janë temperatura, presioni, përqendrimi.
Le të ilustrojmë rëndësinë parashikuese të ekuacioneve të nxjerra si një karakteristikë sasiore e parimit të zhvendosjes së ekuilibrit duke përdorur shembullin e sintezës së amoniakut: N 2 + 3H 2 ↔ 2NH 3 - ∆H

Le të shkruajmë ekuacionin izobar
Le të supozojmë se ky sistem nxehet ΔН<0. Правая часть уравнения изотермы уменьшится (∆Н/RT 2)<0, значит левая часть тоже уменьшится: (d ln к р /d P)<0 (она может уменьшиться за счет уменьшения к р).

Konstanta e ekuilibrit për sintezën e amoniakut ka formën She
mund të ulet për shkak të uljes së presionit të produkteve të reaksionit dhe rritjes së presionit të materialeve fillestare. Kjo do të thotë që kur nxehet, ky reaksion ekzotermik zhvendoset në anën e procesit endotermik të dekompozimit të amoniakut. Ky rezultat bazohet në analizën e izobarit van't Hoff. Është e lehtë të tregohet se pajtohet me parashikimin e parimit të Le Chatelier. Një rezultat i ngjashëm mund të merret duke zbatuar ekuacionet e Planck-ut në analizën e këtij reaksioni, duke pasur parasysh se presioni P është në mënyrë të kundërt 1/V vëllim. Këto veprime sugjerohen të bëhen nga vetë nxënësit.
Varësia e konstantës së ekuilibrit të reaksionit nga temperatura mund të përshkruhet nga ekuacioni i izobarit të një reaksioni kimik (van't Hoff izobar):
dhe izokoret e një reaksioni kimik (van't Hoff isochores):
![]()
Këtu Δ H dhe Δ Uështë efekti termik i një reaksioni që vazhdon, përkatësisht, në një presion konstant ose në një vëllim konstant. Nëse Δ H> 0 (efekti termik është pozitiv, reaksioni është endotermik), pastaj koeficienti i temperaturës së konstantës
ekuilibri është gjithashtu pozitiv, domethënë, me rritjen e temperaturës, rritet konstanta e ekuilibrit të reaksionit endotermik, ekuilibri zhvendoset djathtas (që është mjaft në përputhje me parimin e Le Chatelier).
Konstanta e ekuilibrit dhe konstanta e shpejtësisë së reagimit
Për një reaksion kimik të kthyeshëm, konstanta e ekuilibrit mund të shprehet në terma të konstantave të shpejtësisë së reaksioneve të përparme dhe të kundërta, bazuar në faktin se në gjendjen e ekuilibrit, shpejtësitë e reaksioneve të përparme dhe të kundërta janë të barabarta. Për shembull, për një reaksion kimik elementar të kthyeshëm të rendit të parë
është e lehtë të tregosh se:
Ku k 1 është konstanta e shpejtësisë së reaksionit të drejtpërdrejtë, dhe k 2 - anasjelltas. Kjo marrëdhënie e rëndësishme siguron një nga "pikat e kontaktit" midis kinetikës kimike dhe termodinamikës kimike.
Metodat për llogaritjen e konstantës së ekuilibrit
Metodat e llogaritjes për përcaktimin e konstantës së ekuilibrit të një reaksioni zakonisht zbresin në llogaritjen në një mënyrë ose në një tjetër ndryshimin standard në energjinë Gibbs gjatë reaksionit ( ΔG 0 ) dhe më pas duke përdorur formulën:
Duhet mbajtur mend se energjia Gibbs është një funksion i gjendjes së sistemit, domethënë nuk varet nga rruga e procesit, nga mekanizmi i reagimit, por përcaktohet vetëm nga gjendjet fillestare dhe përfundimtare të sistemit. . Prandaj, nëse një përkufizim ose llogaritje e drejtpërdrejtë ΔG 0 për disa reagime janë të vështira për disa arsye, ju mund të zgjidhni reagime të tilla të ndërmjetme për të cilat ΔG 0 dihet ose mund të përcaktohet lehtësisht, dhe përmbledhja e të cilave do të japë reagimin në fjalë (shih Ligjin e Hesit). Në veçanti, reagimet e formimit të komponimeve nga elementët shpesh përdoren si reagime të tilla të ndërmjetme.
Llogaritja e entropisë e ndryshimit të energjisë së Gibbs-it dhe konstantës së ekuilibrit të reaksionit
Metoda e llogaritjes së entropisë ΔG Reaksionet janë një nga më të zakonshmet dhe më të përshtatshmet. Ai bazohet në raportin:
ose, përkatësisht, për standarde Ndryshimet e energjisë së Gibbs:
Këtu ΔH 0 në presion dhe temperaturë konstante, është e barabartë me efektin termik të reaksionit, metodat e llogaritjes dhe përcaktimit eksperimental të të cilit janë të njohura - shih, për shembull, ekuacionin Kirchhoff:
![]()
Është e nevojshme të merret ndryshimi i entropisë gjatë reaksionit. Ky problem mund të zgjidhet në disa mënyra, për shembull:
Sipas të dhënave termike - bazuar në teoremën termike të Nernst dhe duke përdorur informacione në lidhje me varësinë nga temperatura e kapacitetit të nxehtësisë së pjesëmarrësve në reaksion. Për shembull, për substancat që janë në gjendje të ngurtë në kushte normale:
![]()
ku S 0 = 0 (postulati i Planck-ut) dhe pastaj, përkatësisht,
![]() .
.
(këtu sol indeksi është nga solid anglisht). Në një temperaturë të caktuar T:
![]()
Për substancat që janë të lëngëta ose të gazta në temperaturë normale, ose, në përgjithësi, për substancat që i nënshtrohen një tranzicioni fazor në intervalin e temperaturës nga 0 (ose 298) në T, duhet të merret parasysh ndryshimi në entropinë që lidhet me këtë tranzicion fazor. .
Për gazet ideale - me metodat e statistikave kuantike.
Metoda të ndryshme empirike dhe gjysmë empirike, për këtë shpesh mjafton një sasi e vogël e të dhënave fillestare. Për shembull, për substancat e ngurta inorganike, entropia mund të vlerësohet duke përdorur formulën
ku A dhe B janë konstante tabelare në varësi të llojit të përbërjes në fjalë, M është pesha molekulare.
Pra, nëse , dhe varësitë nga temperatura e kapacitetit të nxehtësisë janë të njohura, mund të llogaritet me formulën:
Një version disi i thjeshtuar i kësaj formule është marrë duke supozuar se shuma e kapaciteteve të nxehtësisë së substancave është e pavarur nga temperatura dhe e barabartë me shumën e kapaciteteve të nxehtësisë në 298 K:
Dhe një llogaritje edhe më e thjeshtuar kryhet duke barazuar shumën e kapaciteteve të nxehtësisë me zero:
Kalimi nga në konstantën e ekuilibrit kryhet sipas formulës së mësipërme.
Parimi Le Chatelier-Brown(1884) - nëse një sistem në ekuilibër të qëndrueshëm veprohet nga jashtë, duke ndryshuar ndonjë nga kushtet e ekuilibrit (temperatura, presioni, përqendrimi), atëherë proceset që synojnë kompensimin e ndikimeve të jashtme intensifikohen në sistem.
Henri Le Chatelier (Francë) formuloi këtë parim termodinamik të ekuilibrit në lëvizje, të përgjithësuar më vonë nga Karl Brown
Le të shqyrtojmë një reagim të përgjithshëm reagimi
Studimet eksperimentale tregojnë se relacioni i mëposhtëm plotësohet në gjendjen e ekuilibrit:

(kllapat katrore tregojnë përqendrimin). Raporti i mësipërm është një shprehje matematikore e ligjit të veprimit të masës, ose ligjit të ekuilibrit kimik, sipas të cilit, në një gjendje ekuilibri kimik në një temperaturë të caktuar, produkti i përqendrimeve të produkteve të reaksionit në fuqi, tregues.
të cilët janë të barabartë me koeficientët përkatës në ekuacionin stekiometrik të reaksionit, pjesëtuar me një produkt të ngjashëm të përqendrimeve të reaktantëve në fuqitë përkatëse, është një vlerë konstante. Kjo konstante quhet konstante e ekuilibrit. Shprehja e konstantës së ekuilibrit për sa i përket përqendrimeve të produkteve dhe reaktantëve është tipike për reaksionet në tretësirë.
Vini re se ana e djathtë e shprehjes për konstantën e ekuilibrit përmban vetëm përqendrimet e substancave të tretura. Ai nuk duhet të përfshijë asnjë term që lidhet me lëndët e ngurta të pastra, lëngjet e pastra, tretësit që marrin pjesë në reaksion, pasi këto terma janë konstante.
Për reaksionet që përfshijnë gaze, konstanta e ekuilibrit shprehet në terma të presioneve të pjesshme të gazeve, dhe jo në terma të përqendrimeve të tyre. Në këtë rast, konstanta e ekuilibrit shënohet me simbolin .
Përqendrimi i një gazi mund të shprehet në termat e presionit të tij duke përdorur ekuacionin ideal të gjendjes së gazit (shih seksionin 3.1):
Nga ky ekuacion del
ku është përqendrimi i gazit, i cili mund të shënohet si [gaz]. Meqenëse është një vlerë konstante, ne mund ta shkruajmë atë në një temperaturë të caktuar
Le të shprehim konstantën e ekuilibrit për reaksionin ndërmjet hidrogjenit dhe jodit në terma të presioneve të pjesshme të këtyre gazeve.
Ekuacioni për këtë reaksion ka formën
Prandaj, konstanta e ekuilibrit të këtij reaksioni jepet nga
![]()
Le t'i kushtojmë vëmendje faktit që përqendrimet ose presionet e pjesshme të produkteve, d.m.th., substancat e treguara në anën e djathtë të ekuacionit kimik, formojnë gjithmonë një numërues dhe përqendrimet ose presionet e pjesshme të reagentëve, d.m.th. të treguara në anën e majtë të ekuacionit kimik, formoni gjithmonë emëruesin e shprehjes për konstantën e ekuilibrit.
Njësitë për konstantën e ekuilibrit
Konstanta e ekuilibrit mund të rezultojë të jetë një sasi dimensionale ose pa dimension, në varësi të llojit të shprehjes së saj matematikore. Në shembullin e mësipërm, konstanta e ekuilibrit është pa dimension, sepse numëruesi dhe emëruesi i thyesës kanë të njëjtat dimensione. Përndryshe, konstanta e ekuilibrit ka një dimension të shprehur në njësi të përqendrimit ose presionit.
Sa është dimensioni i konstantës së ekuilibrit për reaksionin e mëposhtëm?
Prandaj, ai ka dimensionin (mol-dm-3)

Pra, dimensioni i konstantës së konsideruar të ekuilibrit ose dm3/mol.
Sa është dimensioni i konstantës së ekuilibrit për reaksionin e mëposhtëm?

Konstanta e ekuilibrit të këtij reaksioni përcaktohet nga shprehja
Prandaj, ajo ka dimensionin
![]()

Pra, dimensioni i kësaj konstante ekuilibri: atm ose Pa.
Ekuilibri heterogjen
Deri më tani, ne kemi dhënë shembuj vetëm të ekuilibrave homogjenë. Për shembull, në reaksionin e sintezës së jodidit të hidrogjenit, si produkti ashtu edhe të dy reaktantët janë në gjendje të gaztë.
Si shembull i një reaksioni që çon në një ekuilibër heterogjen, merrni parasysh ndarjen termike të karbonatit të kalciumit
Konstanta e ekuilibrit të këtij reaksioni jepet nga
![]()
Vini re se kjo shprehje nuk përfshin asnjë term që i referohet dy trupave të ngurtë të përfshirë në reagim. Në shembullin e treguar, konstanta e ekuilibrit është presioni i disociimit të karbonatit të kalciumit. Tregon se nëse karbonati i kalciumit nxehet në një enë të mbyllur, atëherë presioni i tij i disociimit në një temperaturë fikse nuk varet nga sasia e karbonatit të kalciumit. Në pjesën tjetër, do të mësojmë se si ndryshon konstanta e ekuilibrit me temperaturën. Në shembullin në shqyrtim, presioni i disociimit tejkalon 1 atm vetëm në një temperaturë më lart.
Epo, ne kemi filluar të hyjmë në thelbin e çështjes. Tashmë duhet të kuptoni se çfarë është një variabël dhe si të përdorni kushtet në programet tuaja. Shpresoj që të jetë kështu, përndryshe çdo gjë tjetër është e pakuptimtë për ju të lexoni.
Kur fola për variabla, hoqa një lloj tjetër ndryshoreje. Kjo variabël, ndryshe nga të tjerat, e ruan vlerën e saj për kohëzgjatjen e ekzekutimit të programit. Fillohet në deklaratë dhe nuk mund të ndryshohet në kodin e mëtejshëm. Një ndryshore e tillë quhet konstante.
Për çfarë janë konstantet? Për të ruajtur informacione të përhershme. Sado që nuk do të doja të bëja krahasime matematikore, megjithatë, ato janë më të dukshmet. Mos harroni fizikën - konstanten gravitacionale, temperaturën në Kelvin, Fahrenheit, etj. Të gjitha këto janë konstante. Në fakt, ne deklaruam një herë një variabël të tillë dhe harruam vlerën e saj, duke zëvendësuar emrin e saj në program. ju mund të pyesni, pse të mos përdorni një variabël të thjeshtë për të ruajtur këtë informacion? Por sepse mund t'i caktoni një vlerë të ndryshme kësaj ndryshoreje, por jo një konstante.
Le të shohim sintaksën dhe më pas do të jap një shembull të mirë.
Në C, një konstante u përcaktua me direktivë # përcaktojnë
#define PI 3.14 // PI tani do të përmbajë 3.14
Kjo direktivë mund të gjendet në shumë programe aktuale, por kjo është një qasje e vjetëruar. C++ prezantoi një modifikues të ri konst.
Const float PI=3.14;\
Const float PI=3.14; int _tmain(int argc, _TCHAR* argv) ( setlocale (0,""); //cakto gjuhën e paracaktuar (rusisht) int S,R=21; //zona dhe rrezja e rrethit S=PI*R*R ; sistemi ("pauzë"); //për të parandaluar mbylljen e dritares kthen 0; )
Kudo që ta quajmë këtë ndryshore, kudo do të jetë e barabartë me 3.14. Shumë i përshtatshëm, apo jo? Nga rruga, për hir të eksperimentit, përpiquni t'i caktoni një vlerë PI në program. Shihni se si reagon përpiluesi.
Epo, si përfundim, në konstante, mund të them që mund të përdorni një shprehje aritmetike si konstante.
ConstPROIZV=23*12; // tani kemi numrin 276 në konstante
Gjithashtu, mbani mend një rregull - Emrat konstante duhet të shkruhen gjithmonë me shkronja të mëdha! Kjo do ta bëjë jetën më të lehtë edhe për ju, sepse kur të takoni një konstante të formatuar saktë, do të kuptoni menjëherë se është një konstante.
Së bashku me konstantet në programim përdoren gjerësisht transfertat. Në thelbin e tij, është një grup konstantesh. Ato nevojiten për të kufizuar zgjedhjen e një sërë vlerash në një variabël. Mund të jetë një ditë e javës, një muaj, një shenjë sipas gjinisë (mashkull ose femër), etj. Regjistrimet përdoren veçanërisht gjerësisht në shkrimin e lojërave.
Epo, le të harrojmë tani atë që shkrova më lart dhe ta konsiderojmë numërimin me një shembull.
Numrat duhet të deklarohen jashtë funksionit kryesor. Çështja është se është një lloj i përcaktuar nga programuesi. Dhe lloje të tilla, së bashku me strukturat dhe klasat, duhet të deklarohen, mundësisht në një modul të veçantë. Por ne do t'i shqyrtojmë të gjitha këto shumë më vonë. Ja se si deklarohet një numër:
enum Muaji (janar, shkurt, mars, prill, maj, qershor, korrik, gusht, shtator, tetor, nëntor, dhjetor);
Një numërim fillon me fjalën kyçe enum, e ndjekur nga emri i numërimit ( nuk është një variabël!, dhe grupi i vlerave tregohet në kllapa.
Tani mund të përdorim llojin e deklaruar në programin tonë:
Int main () ( Muaji curMonth=Qershor; // CurMonth tani mban // Korrik )
Çfarë mendoni se ruhet në variablin curMonth? Nëse mendoni se qershori, atëherë gaboheni. Një enum është një lloj numerik dhe është hedhur në mënyrë implicite në int. Numërimi fillon nga 0. Duke ditur këtë, mund të supozojmë se curMonth përmban numrin 5. Me fjalë të tjera, ne mund t'i caktojmë kësaj ndryshore në vend të emrit të muajit homologun e tij numerik në interpretimin e numërimit dhe do të kishim të drejtë.
Sigurisht, një shembull me një muaj ose një ditë të javës nuk është shumë i qartë. Sidoqoftë, duhet të kuptoni se një variabël mund të kufizohet në një gamë vlerash. Provojeni, vendosni curMonth në diçka tjetër përveç një enum dhe shikoni se si ju thërret përpiluesi J.
Por në programim, për shembull, në Windows, shpesh do të hasim numërime dhe konstante. Këtu do të kuptoni plotësisht të gjithë komoditetin e përdorimit të tyre.
Tani le të kthehemi te shembulli ynë dhe të shohim se çfarë tjetër mund të ndryshojmë. Muajt numërohen nga një, jo nga zero. Nga kodi ynë, mund të shihni që qershorit 100 i është caktuar vlera 5, jo 6. Epo, ju mund të vendosni numërimin tuaj në numërim.
I caktova Janit në mënyrë eksplicite vlerën 1. Përpiluesi automatikisht do t'i caktojë vlerat e nevojshme për pjesën tjetër të muajve. Sigurisht, ju mund të vendosni gjithçka me dorë, por thjesht nuk ka kuptim.
Dhe së fundi. Një variabël mund të deklarohet gjithashtu kur përcakton një numërim:
Muaji i numrit (janar=1, shkurt, mars, prill, maj, qershor, korrik, gusht, shtator, tetor, nëntor, dhjetor) këtë muaj;
Atëherë kjo variabël mund të përdoret tashmë në program. Shumë prej tyre mund të postohen atje. Por personalisht nuk më pëlqen kjo metodë, duke e konsideruar disi konfuze. Në fund të fundit, ne nuk po programojmë në C, por në C++.
Cast
Këtu, lexoni me kujdes. Fakti është se C++ është i famshëm për gabimet e tij aritmetike në llogaritjet. Jo, ajo e konsideron gjithçka të saktë, vetëm rezultati i llogaritjes varet fuqimisht nga lloji i ndryshores. Një programues që zgjedh të hedhë koeficientin si int shpesh nuk arrin të marrë rezultatin e dëshiruar. Fakti është se përpiluesi i gjuhës kryen konvertime të nënkuptuara të tipit.
Këtu është një shembull. Duhet të llogarisim pagën e një punonjësi. Ne e dimë shpejtësinë e orës. Pastaj e shumëzojmë këtë vlerë me numrin e orëve të punës dhe marrim rezultatin e dëshiruar. Gjithçka është e thjeshtë këtu. Por imagjinoni një drejtor që punëson një punonjës dhe nuk e di se sa duhet të paguhet. Pastaj merr rrogën për rajonin dhe e ndan me numrin e orëve.
Int zarp, orë, vel; vel=22320; // paga në qytet është 22320 rubla orë=22 * 8; //numri i orëve është i barabartë me 22 ditë pune * 8 orë ditë pune zarp=vel / orë; // ora jonë cout<<"Час работника стоит =" < Programi do të na japë një shifër prej 126 rubla. Kjo na përshtatet, por është e lehtë të marrim një kalkulator dhe të llogarisim që në fakt numri është 126.8. Dhe nëse punonjësi nuk ofendohet nga kjo mungesë, atëherë gabime të tilla në llogaritjet janë të papranueshme. Cfare ndodhi? zarp është një numër i plotë dhe ruan vetëm një vlerë të plotë. Pjesa e pjesshme do të hidhet poshtë. Me fjalë të tjera, ishte e nevojshme të përdorej tipi i dyfishtë, i cili do të ruante fraksionin. Dhe këtu situata është disi më interesante. Përpiluesi cakton përkohësisht llojin e dyfishtë variablave orë dhe vel, sikur zgjeron vlerën e tyre. Ne mund të mos jemi të vetëdijshëm për këtë, megjithëse është e rëndësishme ta kuptojmë. Kompiluesi, kur ndeshet me një tip më të madh, i cakton operandit të tij me një tip më të vogël një vlerë. Ky është i gjithë rregulli. Sidoqoftë, imagjinoni një situatë ku një programues paranojak harxhon kot kujtesën (mos harroni se dyfishi është 2 herë më i madh se int?) dhe përpiqet të caktojë saktësisht këtë lloj kudo. Po, merr vlerën e saktë, duke sakrifikuar disa performanca (operacionet me tipe fraksionale janë më të ngadalta se me llojet e numrave të plotë, por kjo nuk është më e rëndësishme), por ju jeni duke e mbështetur artificialisht veten në një cep. Le të kthehemi te drejtori ynë, i cili ende nuk e di se sa duhet të paguajë për punën e tij. Supozoni se një llogaritar skrupuloz i dha atij një tarifë për orë prej 132.12 rubla. I caktoni menjëherë një vlerë të dyfishtë, filloni llogaritjen dhe ulërini kur qindarkat shfaqen kudo. Epo, ne nuk kemi nevojë t'i japim ato punonjësit! Në këtë rast, nëse keni bërë një gabim të tillë, mund të bëni një cast eksplicit. Në C u bë kështu: shprehje (lloji i hedhur).
(in)vel; // hedh artificialisht llojin në një numër të plotë. Në C++, Stroopstrup prezantoi një transformim të ri. Këtu është përshkrimi i tij: statike
_
të hedhura
<тип>(shprehje)
Konvertimet konsiderohen si shenjë e shijes së keqe të programimit. Nëse keni shumë transformime, atëherë ka shumë të ngjarë që ju duhet të ndryshoni të gjitha vlerat në program. Megjithatë, transformimet përdoren shpesh në OOP. Ne nuk do të ndalemi ende në to, gjithsesi, me praktikë, do të kuptoni gjithçka menjëherë. Kështu që shkoni të pushoni pak. Mësimi i ardhshëm do të jetë më i vështirë dhe shumë më i rëndësishëm. Unë nxitoj t'ju kënaq - kanë mbetur disa mësime nga ky fondacion dhe ne do të fillojmë programimin normal.